CO的应用和治理问题属于当今社会的热点问题。
(1)在实验室中以甲酸和浓硫酸混合加热制取CO,该反应的方程式是:__________;
(2)HCOOH的酸性略强于醋酸,是实验室制取CO的主要试剂,在0.1mol/L HCOOH溶液中,溶质分子和各种离子浓度由大到小的顺序为 。常温下,将0.2mol/L HCOOH和0.1mol/LNaOH溶液等体积混合,所得溶液的pH<7,说明HCOOH的电离程度________HCOONa的水解程度(填“大于”或“小于”)。该溶液中c(HCOOH)-c(OH-) +c(H+)=______mol/L
(3)已知:硫的燃烧热为296 kJ/mol;一氧化碳燃烧热为283 kJ/mol。为防止镍系催化剂中毒,工业上常用SO2除去原料气中少量CO,生成物为固体S和CO2。该反应的热化学方程式为 。
(4)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g) 
 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,如图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,如图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
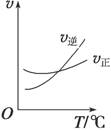
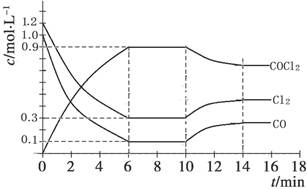
①0~6 min内,反应的平均速率v(COCl2)= ;
②若保持温度不变,在第8 min 加入体系中的三种物质各3mol,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不移动”);
③在恒温恒压条件下,若将初始投料浓度变为c(Cl2)=amol/L、c(CO)=bmol/L、c(COCl2)=cmol/L,(a、b、c都大于0)则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同,则a、b、c三种物质的关系是________
④随温度升高,该反应平衡常数变化的趋势是 。(填“增大”、“减小”或“不变”)
已知铜和浓硫酸可以在加热条件下发生反应,化学方程式如下(已配平):
Cu+2H2SO4(浓) CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)在参加反应的硫酸中,被还原的硫酸与未被还原的硫酸的物质的量之比为 。A物质可以与强碱反应生成盐和水。则A应该属于 (用字母代号填写)。
a.酸
b.碱
c.盐
d.酸性氧化物
e.碱性氧化物
(2)一定量的铜片与含1.8mol H2SO4的浓H2SO4充分反应(浓H2SO4过量),如果该反应过程中转移了0.2 mol电子,生成的CuSO4的质量为 g,生成的A气体在标准状况下体积为 L(假设气体全部逸出)。
(3)将(2)中反应后所得到的溶液稀释后与足量Ba(OH)2溶液反应,所得沉淀的质量为 g。写出此过程中发生反应的离子方程式:
,
。
实验室要配制0.1mol/L的稀硫酸980mL,回答下列问题:
(1)需要98%密度为1.84g/cm3的浓硫酸 ______ mL
(2)配制时,必须使用的仪器有______(填代号)还缺少的仪器是______、______。
①烧杯 ②10 mL量筒③20 mL量筒 ④托盘天平(带砝码) ⑤玻璃棒
(3)配制时,该实验两次用到玻璃棒,其作用分别是______、______。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①用量筒量取98%的硫酸时俯视。()
②如果加水超过了刻度线,取出水使液面恰好到刻度线。()
③容量瓶没有干燥。()
近年来,我国对储氢纳米碳管的研究获得了重大进展,电弧法合成的纳米碳管常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化法提纯。其反应的化学方程式为:
C + K2Cr2O7+ H2SO4(稀)="=" CO2+ K2SO4+ Cr2(SO4)3+
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂是 ,氧化产物是 。
(3)H2SO4在上述反应中表现出来的性质是 。
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)上述反应中若产生11.2 L(标准状况下)的气体物质,则转移的电子数目为 。
铁与HNO3作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知铁与冷的稀HNO3反应时,主要还原产物为NO气体;与热的稀HNO3反应时,主要还原产物为N2O气体;当HNO3更稀时,其主要还原产物是NH4+。现有铁与稀 HNO3的作用,请分析下图,回答有关问题。假设曲线的各段内只有一种还原产物。
(1)0点到a点的还原产物是 。
(2)a点到b点的还原产物是 ,其原因可能是 。
(3)试完成b点到c点的反应方程式:
□Fe+□HNO3——□Fe( NO3)3+□[ ]+□H2O
(4)反应过程中,到达 点时,HNO3已完全反应。
(5)已知达到d点时反应结束,此时溶液中的主要阳离子是Fe2+,则c点和d点参加反应的铁的物质的量之比是 。
科学研究表明,月球上有丰富的He资源,可开发利用作未来的新型能源。
(1)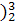 He的中子数是
He的中子数是 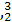 He与
He与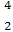 He互称为 。
He互称为 。
(2)α粒子是带有2个单位正电荷、质量数为4的原子核,由此推断α粒子含有 个质子和 个中子。
(3)在 He
He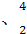 He两种核素中,原子核内的中子数相差为 ,与α粒子有相同质子数和中子数的是 。
He两种核素中,原子核内的中子数相差为 ,与α粒子有相同质子数和中子数的是 。