【化学—选修5有机化学基础】某芳香烃A是有机合成中非常重要的原料,通过质谱法测得其最大质荷比为118;其核磁共振氢谱中有5个峰,峰面积之比为1:2:2:2:3;其苯环上只有一个取代基。以下是以A为原料合成高分子化合物F、I的路线图,试回答下列问题:
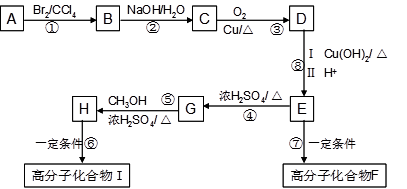
(1)A的结构简式为 。
(2)D中的官能团名称是 。
(3)I的结构简式为 。
(4)上述反应中属于取代反应的是 。
(5)反应⑥、⑦生成的高分子化合物的反应原理是否相同 。
(6)写出下列反应的化学方程式:
反应⑤ ;反应⑦ 。
(7)符合以下条件的D的同分异构体有 种(不考虑立体异构)。
| A.苯环上有两个取代基 | B.苯环上的一氯代物有两种 |
| C.加入三氯化铁溶液不显色 | D.能发生银镜反应 |
经研究发现有白蚁信息素有: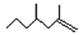 (2,4-二甲基-1-庚烯) ,
(2,4-二甲基-1-庚烯) ,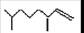 (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)2CH=CH—CH=CH(CH2)8CH3。试完成下列问题:
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)2CH=CH—CH=CH(CH2)8CH3。试完成下列问题: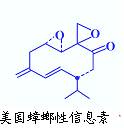
(1)下列说法正确的是。
| A.以上三种信息素互为同系物 | B.以上三种信息素均能使溴的四氯化碳溶液褪色 |
| C.2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同系物 | |
| D.家蚕信息素与1molBr2加成产物只有一种 |
(2)烯烃A是2,4-二甲基-1-庚烯的一种同分异构体,A与足量氢气加成得到烷烃B,B的一氯代物只有2种;烯烃C是3,7-二甲基-1-辛烯的一种同分异构体,C与氢气加成得到烷烃D,D的一氯代物也只有2种,则B的结构简式为:。C的结构简式为:。
(3)美国蟑螂性信息素结构式如右图,分子中含有手性碳原子 个;有机物E与该信息素互为同分异构体,E能发生银镜反应又能与碳酸氢钠溶液反应,若E表示为: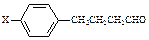 ,X可能的结构有种。
,X可能的结构有种。
马格尼特法冶炼镁的工艺流程如下图。炉料中除有煅烧白云石和硅铁外,还加入煅烧过的铝土矿,加Al2O3的主要目的是降低渣的熔点,便于液态排渣。
已知白云石的成分为CaCO3·MgCO3,硅铁是指含有55%硅左右的铁[可表示为Si(Fe)],作还原剂,最后得到低品位的硅铁[可表示为Fe(Si)],简易流程图如下
试回答下列问题
(1)反应①,白云石煅烧得CaO·MgO的化学方程式为:。
(2)反应②,还原炉中发生反应生成镁和炉渣的化学方程式为:。
(3)该成分的沪渣是一种工业生产的重要原料,可作为生产原料。
(4)马格尼特法冶炼镁,一台4500千瓦的炉子可日产约7.2吨镁,一天至少约消耗含硅60%的硅铁吨。
已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体,Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁铁矿的主要成分,D、H、K均是重要的工业产品,X分子的球棍模型如图所示,图中部分反应条件已略去。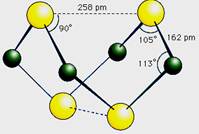
试回答下列问题
(1)写出化学式:DX 。
(2)E的电子式为:。
(3)写出化学方程式:①;②。
X、Y、Z三种元素的原子,核外均未出现3d电子。已知:1、 X+和Y-两种离子具有相同的核外电子排布类型;2、 Z元素原子核内的质子数比Y元素原子核内的质子数少9。 请回答下列问题:
(1)写出X、Y、Z三种元素的元素符号X,Y, Z。
(2)Y元素能形成多种含氧酸,其中酸性最强的含氧酸的化学式为 。
(3)含有这三种元素的一种化合物常在实验室中用来制备O2,写出该反应的化学方程式: 。每生成1molO2,转移的电子数为 mol。
A~H以及X、Y的转化关系如图: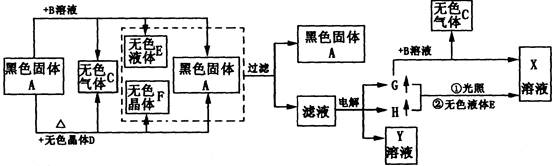
(1)电解上述滤液时产生G的电极是。其电极反应式为。
(2)取上图中滤液做焰色反应显紫色,上图中焰色反应显紫色的还有。
(3)写出黑色固体与X浓溶液共热反应的离子方程式。
(4)写出G与B溶液反应的化方程式。