硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如下。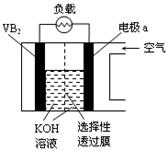
该电池工作时总反应为:4VB2 + 11O2= 4B2O3 + 2V2O5。下列说法正确的是
| A.硼化钒(VB2)为电池的正极 |
| B.电池持续反应过程中,选择性透过膜只能用阳离子交换膜 |
| C.电路中通过1mole−时消耗硼化钒6.6g |
| D.VB2极发生的电极反应为:2VB2 + 28OH--22e−= 2VO3- + 4B(OH)4-+ 6H2O |
下列根据实验操作和现象所得出的结论不正确的是()
| 选项 |
实验操作 |
实验现象 |
结 论 |
| A |
测定等浓度的Na2CO3和Na2SO3 溶液的pH |
前者pH比后者的大 |
非金属性:S>C |
| B |
SO2通入酸性高锰酸钾溶液 |
高锰酸钾溶液褪色 |
SO2具有还原性 |
| C |
溴乙烷与NaOH溶液共热后,加HNO3酸化的AgNO3溶液 |
出现淡黄色沉淀 |
溴乙烷发生了水解 |
| D |
向等浓度的KBr、KI混合液中滴加AgNO3溶液 |
先出现黄色沉淀 |
Ksp(AgBr)>Ksp(AgI) |
某强碱性溶液中含有的离子是:K+、NH4+、A13+、AlO2-、CO32-、SiO32-、Cl-中的某几种,现进行如下实验:
①取少量的溶液用足量硝酸酸化后,该溶液无沉淀生成;
②另取一定量原溶液,逐滴加人盐酸至过量,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
③另取一定量的原溶液中加人5 mL0. 2 mol/L盐酸时,沉淀会完全消失,加人足量的硝酸银溶液可得到沉淀0.187 g。下列说法中正确的是 ()
| A.该溶液中一定不含NH4+、A13+、SiO32-、Cl- |
| B.该溶液中一定含有A13+、CO32-、Cl- |
| C.Cl-可能含有 |
| D.该溶液中一定含有AlO2-、CO32-、Cl- |
下列溶液中有关物质的浓度关系正确的是 ()
| A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) >c[(NH4)2SO4]>c(NH4Cl) |
| B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.1.0 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| D.某二元弱酸酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
把铜粉放入装有浓氨水的试管中,塞紧试管塞,振荡后发现试管塞越来越紧,且溶液逐渐变为浅黄色(近乎无色)溶液,打开试管塞后,溶液迅速变为蓝色溶液。则下列说法不正确的是()
| A.试管塞越来越紧,是因为反应消耗了大量O2 |
| B.打开试管塞前Cu元素的化合价为+1价 |
C.溶液迅速变为蓝色溶液,是因为反应生成了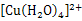 |
| D.上述反应原理可用于测定O2的含量 |
Li-SOCl2电池可用于心脏起搏器。电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl +S +SO2。电池工作时,下列说法不正确的是 ()
| A.锂电极发生氧化反应 |
| B.电子从锂电极通过外电路流向碳电极 |
| C.每生成1mol SO2转移4mol电子 |
| D.SOCl2既是氧化剂又是还原剂 |