(14分)工业上可以利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2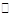 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
(2)如果只改变一个条件使上述反应方程式的平衡常数K值变大,则该反应__ (选填编号)。
| A.一定向正反应方向移动 |
| B.在平衡移动时正反应速率先增大后减小 |
| C.一定向逆反应方向移动 |
| D.在平衡移动时逆反应速率先减小后增大 |
(3)其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图所示。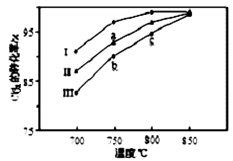
①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是________。
②a点所代表的状态________(填“是”或“不是”)平衡状态。
③c点CO2的转化率高于b点,原因是________。
(4)若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度减少了2.0g/L,在这段时间内CO2的平均反应速率为 。反应在t1时达到平衡,过程中c(CO2)随时间t变化趋势曲线下图所示。保持其他条件不变,t1时将容器体积压缩到1L,请在图中画出t1后c(CO2)随时间t变化趋势曲线(假定t2时刻达到新的平衡)。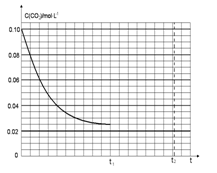
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含的离子如下表所示:
| 阳离子 |
NH4+、Na+、Mg2+ |
| 阴离子 |
OH-、NO3—、SO42— |
取等质量的三种化合物配制成相同体积的溶液,其溶质的物质的量浓度:c(甲)>c(乙)>c(丙)。
(1)甲是________,向AlCl3溶液中逐滴加入甲溶液,观察到的现象是________,对应的离子方程式为________。
(2)乙是______,设计实验确定乙的物质组成________(若乙已确定,则不填该空)。
生活和生产中常用到胶体的性质,请看下述四例:
(1)做实验时,手指不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,其原理是
_______________________________________________。
(2)在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量。解决方法之一是把这些陶土和水一起搅拌,使微粒直径在10-9~10-7m之间,然后插入两根电极,再接通直流电源。这时阳极聚集陶土胶粒,阴极聚集氧化铁胶粒,理由是________。
(3)水泥和冶金工厂常用高压电对气溶胶作用以除去大量烟尘,减少对空气的污染,这种作用运用了________原理。
(4)四氧化三铁在强碱性溶液中与次氯酸盐反应,生成高铁酸盐(FeO42—),FeO42—有强氧化性,可以杀菌消毒。高铁酸盐还有净化水的作用,能净化水的原因是 ______________________________________________________
已知A、B,C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按下图进行反应。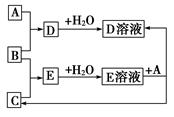
回答下列问题:
(1)A、B、C三种元素中的任意两种元素形成的化合物所属物质类别一定不是________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
(2)A、B、C三种元素中有一种是金属,则这种元素是A、B、C中的________,理由是________。
(3)如果E溶液是一种强酸,则E的化学式为________。
无机化合物可根据其组成和性质进行分类:
(1)下图所示的物质分类方法名称是________
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学式 |
HCl②____ |
③___④Ba(OH)2 |
⑤Na2CO3⑥____ |
⑦CO2⑧Na2O2 |
(3)写出⑦转化为⑤的化学方程式_____________________________
(4)呼吸面具中用⑧作为O2来源的反应原理为:___________________________
(5)实验室制备⑦常用________和________反应,检验该气体的方法是____________
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1)现有下列6种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2。按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①________________________________。
②________________________________。
(2)从上述物质中分别找出两种能相互反应的物质,各写一个非氧化还原反应的方程式和氧化还原反应的方程式__________________________________________________
(3)虽然分类的方法不同,但离子反应和氧化还原反应之间也存在着一定的关系,请用简单的图示方法表示二者之间的关系:___________________________。
(4)生活中的食醋和淀粉溶液分别属于分散系中的________和________,用________可以鉴别(填化学专用名词)。