下列实验操作过程能引起结果偏高的是( )
①用已知浓度的盐酸滴定未知浓度的NaOH溶液时,酸式滴定管未用标准液润洗。
②用量筒量取5.0mL溶液时,俯视读数。
③配制一定物质的量浓度的硫酸溶液,定容时仰视容量瓶的刻度线。
④用已知浓度的盐酸滴定未知浓度的NaOH溶液时,滴定前平视读数,滴定终点仰视读数。
| A.③④ | B.②③ | C.①④ | D.①② |
下列化学用语书写正确的是( )
| A.次氯酸的结构式:H—Cl—O |
B.丙烷分子的球棍模型示意图: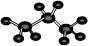 |
C.NH4H的电子式: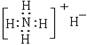 |
D.S2-的结构示意图: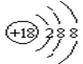 |
下列说法正确的是()
| A.PM2.5作为空气质量预报的一项重要指标,它是指空气中直径大于或等于2.5μm的颗粒物,该值越高,代表空气污染程度越严重。 |
| B.最近天津市对小轿车进行“双限”措施,这种做法是防止酸雨的途径之一,也是减少雾霾的途径之一。 |
| C.镀金的钢铁器件既能增加美观,又可以在即使镀层局部破损后防止器件的损耗。 |
| D.工厂中常用的静电除尘装置是根据胶体带电这个性质而设计的。 |
向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)  xC(g)△H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g)△H<0。测得两容器中c(A)随时间t的变化如图所示:
| 容器 |
甲 |
乙 |
| 容积(L) |
0.5 |
0.5 |
| 反应放热(kJ) |
Q1 |
Q2 |
| 反应物起始量 |
1 molA 1 molB |
0.5 molA 0.5 molB |
下列说法正确的是
A.x=1
B.Q1>2Q2
C.根据题中信息无法计算a值
D.保持其他条件不变,起始时向乙容器充入0.2 mol A、0.2 mol B、0.2 mol C,则此时v(正)> v(逆)
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-) |
| C.已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 |
| D.浓度均为0.1 mol·L-1的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:③>②>① |