在化学实验室,某小组同学实验时发现一瓶没有密封好的NaOH已经结块。于是对其成分进行科学探究,请你一起完成探究的过程。
Ⅰ固体的成分分析
【提出问题】结块后的固体成分是什么?
【猜想与假设】
猜想一:固体为碳酸钠
猜想二:固体为碳酸钠和氢氧化钠。
用化学方程式表示固体中有碳酸钠的原因_____________________________________。
【查阅资料】BaCl2溶液pH=7
【实验探究】从瓶中取出一定量的固体,加入足量水溶解,再将溶液分三等份分别装入A、B、C三支试管,进行如图所示实验。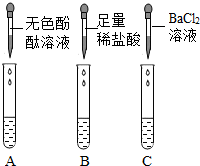
甲同学根据实验现象,认为结块固体中有碳酸钠和氢氧化钠。
【实验分析】
(1)根据甲同学的实验结论可知,三支试管中观察到的实验现象分别为:A试管中________________,B试管出现大量气泡,C试管中出现白色沉淀;
C试管中现象产生的原因是(用化学方程式表示)___________________________。
(2)乙同学认为甲同学的结论是不正确的,原因是_______________________________。
【实验设计】请你设计合理的实验方案,填入下列表格中。
| 操作 |
现象 |
结论 |
| 取少量结块固体于试管(或烧杯)中,加水使其完全溶解,__________________ ______________________ _____________________ |
_______________________ |
固体为碳酸钠和氢氧化钠 |
Ⅱ固体中各成分含量
为确定该固体样品中Na2CO3的质量分数,小芳同学称取2 g样品,利用A为Y形管、B为量气管、C为水准管作为主要反应容器,进行了如图(I)所示实验。
(1)在量气管内水面上架一薄层油,目的是__________________________。
(2)使样品与稀硫酸反应的操作为 __________________________________。
(3)实验结束后,小芳同学读出量气管中的气体体积为22.4ml(已知该温度压强下,CO2的密度为1.965 g/L),请你计算出样品中Na2CO3质量分数。(写出计算过程)
(4)小明同学设计如图(Ⅱ)装置,分别测定反应前、反应后仪器以及仪器内物质的总质量,进行有关计算,实验操作中没有失误,多次测量的结果均偏大,你认为可能的原因是________________________。