下列元素性质的递变规律正确的是
| A.第一电离能:B<Be<Mg<Na |
| B.元素的电负性:O>N>S>P |
| C.气态氢化物的稳定性:NH3<CH4<PH3<SiH4 |
| D.原子半径:Be<B<C<N |
仔细分析下列表格中烃的排列规律,判断排列在第16位的烃的分子式是
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
… |
| C2H2 |
C2H4 |
C2H6 |
C3H4 |
C3H6 |
C3H8 |
C4H6 |
C4H8 |
C4H10 |
… |
A.C6H12B.C6H14C.C7H12D.C7H14
据报道2010年5月俄罗斯特种部队在解救索马里海盗人质时,除使用了非致命武器“芬太奴”外,还使用了一种麻醉作用比吗啡强100倍的氟烷,已知氟烷的化学式为C2HClBrF3,则沸点不同的上述氟烷有
| A.3种 | B.4种 | C.5种 | D.6种 |
纳米材料的表面粒子数占粒子总数的比例很大,这是它有许多特殊性质的原因。假设某硼镁化合物的结构如图所示(六个硼原子位于棱柱内),则这种纳米颗粒的化学式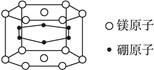
| A.Mg3B6 | B.Mg14B6 | C.MgB2 | D.Mg5B12 |
我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:
HCHO+O2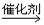 CO2+H2O
CO2+H2O
下列有关说法正确的是
| A.该反应为放热反应 | B.CO2分子中的化学键为非极性键 |
| C.HCHO分子中只含α键不含π键 | D.设生成1.8gH2O消耗2.24L O2 |
氡(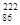 Rn)可从矿泉水、岩石、地下水、天然气、建筑材料中源源不断地释放出来。它可通过呼吸进入人体,停留在呼吸道中,放出α射线,其衰变产物还能放出β、γ射线。这些射线可诱发肺癌。关于氡的下列叙述不正确的是
Rn)可从矿泉水、岩石、地下水、天然气、建筑材料中源源不断地释放出来。它可通过呼吸进入人体,停留在呼吸道中,放出α射线,其衰变产物还能放出β、γ射线。这些射线可诱发肺癌。关于氡的下列叙述不正确的是
| A.Rn的原子核内中子数与质子数的差值为50 |
| B.Rn位于元素周期表中第六周期0族 |
| C.Rn的最外层电子排布式为6s26p6,化学性质不活泼 |
| D.新铺大理石地面的居室,不用打开门窗换气,因为氡对人体无危害 |