A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题:
(1)元素D在周期表中的位置_______________________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)___________.
(3)由A、B、C三种元素以原子个数比4 :2 :3形成化合物X,X中所含化学键类型有______________.
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:____________;若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方________________。
(1)由于金属钠很容易与空气中的________、________等物质反应,通常将它保存在__________里。将一小块钠用小刀切开,可以看到表面光亮,但很快变暗,该反应的化学方程式为,将一小块钠投入水中,发生反应的化学方程式为 ______________________,在反应后的溶液中加入CuSO4溶液,反应的现象是________________________,
反应的方程式为 ___________________________。
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为:
。
漂白粉的有效成分是(填化学式)。
5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。(本题共7分)
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的 离子方程式:
离子方程式:
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸 钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是
钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是
| A.MnO2 | B.KMnO4溶液 | C.稀盐酸 | D.Na2SO3溶液 |
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子的物质的量是_________
某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:(本题共9分)
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色; ③取溶液少许,加
③取溶液少许,加 入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:⑴在实验①中,下图所示的操作中正确的是___________(填代号)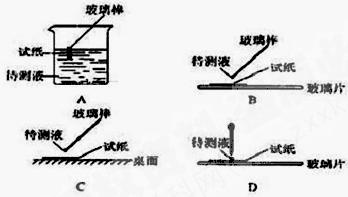
⑵根据上述实验判断原溶液中肯定存在的离子是,肯定不存在的离子是_。
⑶写出与③实验有关的离子方程式:
③_________________________________ ____________________________
____________________________
在上海召开的第七届全球人类基因大会上,我国科学家第一次提出可以用砒霜(As2O3)来治疗早期幼粒白血病。(本题共7分)
(1)完成并配平下列化学方程式:
As2O3+ Zn+ H2SO4→ AsH3+ZnSO4+______
(2)As2O3在上述反应中显示出来的性质是_____________。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(3)若生成0.1 mol AsH3,则转移电子的物质的量为___________mol。
已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:(本题共14分)
① A + B→白色沉淀,加入稀硝酸,沉淀不溶解
② B + D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色
③ C + D→白色沉淀,继续加入D溶液,白色沉淀逐渐消失
⑴试推断A是B是C是 D是。
⑵写出下列反应的离子方程式
A溶液 + B溶液→白色沉淀 ,
,
C溶液与D溶液反应后生成的白色沉淀溶解于D溶液中
。