一种具有除草功效的有机物的结构简式如图所示。下列有关该化合物的说法正确的是
| A.分子中含有2个手性碳原子 |
| B.能发生氧化、取代、加成反应 |
| C.1 mol该化合物与足量浓溴水反应,最多消耗3 mol Br2 |
| D.1 mol该化合物与足量NaOH溶液反应,最多消耗4 mol NaOH |
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是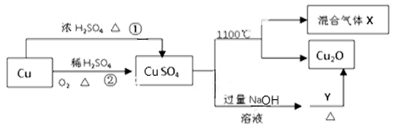
| A.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 |
| B.Y可以是葡萄糖溶液 |
| C.相对于途径①,途径②更好地体现了绿色化学思想 |
| D.将CuSO4溶液蒸发浓缩,冷却结晶可制得胆矾晶体 |
下列实验现象不能说明相关结论的是
| A.向Al(OH)3沉淀中滴加NaOH溶液或盐酸,沉淀均消失,说明Al(OH)3是两性氢氧化物 |
| B.将金属钠投入冷水中,钠熔为小球,说明钠与水的反应为放热反应且钠的熔点低 |
| C.向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl溶解度比Ag2S大 |
| D.将铜与浓硫酸共热,产生使石蕊溶液变红的气体,说明浓硫酸被氧化 |
下列实验或反应中,最后固体质量增加的是
| A.铜丝在空气中灼烧后迅速伸入乙醇蒸气中 |
| B.铁粉与硫粉物质的量之比为1:1时混合加热 |
| C.锌粉加入到氯化铜溶液中 |
| D.去除氧化膜的铝条插入到浓硝酸中 |
某溶液可能含有Cl–、SO42–、CO32–、NH4+、Fe2+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生沉淀;过滤、洗涤、灼烧,得到1.6 g红棕色固体;向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
| A.至少存在4种离子 |
| B.Cl– 一定存在,且c(Cl )≥0.4 mol/L |
| C.SO42–、NH4+一定存在,Cl–可能不存在 |
| D.CO32–、Al3+ 一定不存在,K+可能存在 |
下列类比分析结果正确的是
| A.Fe3O4根据化合价规律可表示为FeO·Fe2O3,则Pb3O4也可表示为PbO·Pb2O3 |
| B.CaC2能水解:CaC2 + 2H2O = Ca(OH)2 + C2H2 ↑,则Al4C3也能水解:Al4C3 + 12H2O = 4A1(OH)3↓+ 3CH4↑ |
| C.Cl2与Fe加热生成FeCl3,则I2与Fe加热生成Fe I3 |
| D.SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液也不产生沉淀 |