在100mL 0.1 mol·L-1 HA的溶液中,c(H+)=0.05mol·L-1,往该溶液中加入等体积等浓度的NaOH溶液(忽略溶液混合体积变化),下列离子浓度关系正确的是
A.c(Na+)> c(A-)> c(H+)> c(OH-)
B.c(A-)+ c(HA)="0.05" mol·L-1
C.c(Na+)> c(A-)> c(HA)>c(OH-)
D.c(HA)+ c(H+)= c(A-)+ c(OH-)
关于下列各装置图的叙述中,不正确的是
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
高温下,某反应达平衡,平衡常数 ,恒容时,温度升高,H2浓度减小。下列说法正确的是
,恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO + H2O CO2+ H2 CO2+ H2 |
镍镉(Ni—Cd)可充电电池在现代生活中有着广泛的应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2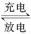 Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是
Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是
| A.Cd(OH)2 | B.Ni(OH)2 | C.Cd | D.NiO(OH) |
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为甲烷,然后将甲烷通入以KOH为电解质的燃料电池发电。电池负极反应为
| A.CH4-8e-+8OH-=CO2+6H2O |
| B.O2+4H++4e-=2H2O |
| C.CH4+10OH--8e-=CO32-+7H2O |
| D.O2+2H2O+4e-=4OH- |
下列有关说法正确的是
| A.反应NH3(g)+HCl(g)= NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C.CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大 |
| D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |