探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是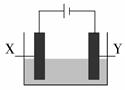
| A.精炼铜时,电解质为硫酸铜溶液,Y电极反应为:Cu2++2e- = Cu |
| B.精炼铜时,溶液中Ag+、Zn2+、Fe2+浓度增大 |
| C.X电极为石墨,Y电极为Cu,则铜受到保护 |
| D.X电极为Fe,Y电极为Cu,则铁受到保护 |
V L硫酸铝溶液中含Al3+的质量为m g,则溶液中SO42-的物质的量浓度为:
A.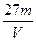 mol·L-1 mol·L-1 |
B. mol·L-1 mol·L-1 |
C.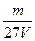 mol·L-1 mol·L-1 |
D.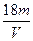 mol·L-1 mol·L-1 |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用相同的是
能正确表示下列反应的离子方程式是
| A.利用腐蚀法制作印刷线路板:Fe3++Cu = Fe2++Cu2+ |
| B.石灰乳与Na2CO3溶液混合:Ca2++CO32- = CaCO3↓ |
| C.碳酸钙溶于醋酸:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:2 +Ba2++2OH-=BaCO3↓+2H2O+ +Ba2++2OH-=BaCO3↓+2H2O+ |
NA为阿伏伽德罗常数,下列叙述错误的是
A.18gH2O中含的质子数为10NA
B.标准状况下,22.4L空气含有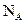
 个单质分子
个单质分子
C .46gNO2和N2O4混合气体中含有原子总数为3NA
.46gNO2和N2O4混合气体中含有原子总数为3NA
D.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
单质X和Y相互反应生成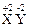 ,现有下列叙述:①X被氧化;②X是氧化剂;③X具有氧化性;④Y2-是还原产物;⑤Y2-具有还原性;⑥X2+具有氧化性;⑦Y的氧化性比X2+的氧化性强。其中正确的是
,现有下列叙述:①X被氧化;②X是氧化剂;③X具有氧化性;④Y2-是还原产物;⑤Y2-具有还原性;⑥X2+具有氧化性;⑦Y的氧化性比X2+的氧化性强。其中正确的是
| A.①②③④ | B.①④⑤⑥⑦ | C.②③④ | D.①③④⑤ |