下图是氢氧燃料电池(电解质溶液为H3PO4溶液)构造示意图。关于该电池的说法不正确的是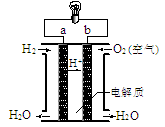
| A.a极是负极 |
| B.电子由a通过灯泡流向b |
| C.正极的电极反应是:O2+2H2O+4e-=4OH- |
| D.氢氧燃料电池是环保电池 |
有关甲、乙、丙、丁四个图示的叙述正确的是()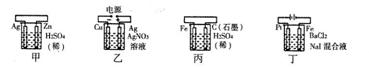
| A.甲中负极反应式为:2H++2e-=H2↑ |
| B.乙中阳极反应式为:Ag++e-=Ag |
| C.丙中H+向石墨棒方向移动 |
| D.丁中电解开始时阴极产生黄绿色气体 |
在下列各组溶液中的离子一定能大量共存的是()
A.加入KSCN溶液显红色的溶液:K+、NH 、Cl-、I- 、Cl-、I- |
B.常温下,pH=1的溶液:Fe3+、Al3+、Br-、SO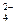 |
C.滴入酚酞试液显红色的溶液:Mg2+、Al3+、Br-、SO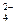 |
D.含 的溶液:K+、Ca2+、NO 的溶液:K+、Ca2+、NO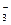 、OH- 、OH- |
用CH4催化还原NO2可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2(g)△H=-1160kJ·mol-1
下列说法不正确的是()
| A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(L)△H>-574kJ·mol-1 |
| B.等物质的量的CH4参加反应时,放出的热量为17.34kJ |
| C.若用0.2moLCH4还原NO2至N2,放出的热量为17.34kJ |
| D.若用0.02moLCH4还原NO2至N2,整个过程中转移的电子总数为0.16mol |
t°C时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下该反应的平衡常数表达式为: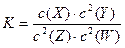 ,有关该平衡体系的说法正确的是()
,有关该平衡体系的说法正确的是()
| A.升高温度,平衡常数K一定增大 |
| B.增大压强,W(g)质量分数增加 |
C.该反应的化学反应方程式为X+2Y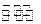 2Z+2W 2Z+2W |
| D.增大X(g)浓度,平衡向逆反应方向移动 |
氯气溶于水达到平衡后,下列叙述正确的是()
A.再通入少量氯气, 减小 减小 |
| B.通入少量SO2,溶液的漂白性增强 |
| C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-) |
| D.该反应的离子方程式为Cl2+H2O=H++Cl-+HClO |