铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O==Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,负极为Fe |
| B.电池放电过程中,负极附近溶液的pH降低 |
| C.电池放电时,若外电路中有2mol电子转移,则内电路中有2molOH-移向正极 |
| D.电池放电时,负极反应为Fe+2OH--2e-==Fe(OH)2 |
下列有关铁及其化合物的说法中正确的是( )
| A.赤铁矿的主要成分是Fe3O4 |
| B.铁与水蒸气在高温下的反应产物为Fe2O3和H2 |
| C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 |
| D.Fe3+与KSCN产生血红色沉淀 |
物质X是某反应中的生成物,其质量变化为先增大,然后减小,下列各操作中指定物质数量变化符合此特征的是( )
| A |
B |
C |
D |
|
| 操作 |
向NaClO溶 液中通入SO2 |
向Na2CO3溶 液中滴加盐酸 |
向NaHCO3溶液 中滴加石灰水 |
向KBr溶液 中滴加稀氯水 |
| X |
Na2SO3 |
NaCl |
Na2CO3 |
Br2 |
某溶液中含有HCO 、CO
、CO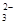 、SO
、SO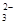 、Na+、NO
、Na+、NO 五种离子。若向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )
五种离子。若向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )
A.NO |
B.CO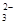 、NO 、NO |
C.SO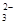 、NO 、NO |
D.CO 、NO 、NO 、Na+ 、Na+ |
下列各组中的实验步骤及现象,能达到相应实验目的的是
| 实验目的 |
实验步骤及现象 |
|
| A |
检验亚硫酸钠试样是否变质 |
试样  白色沉淀 白色沉淀 沉淀不溶解 沉淀不溶解 |
| B |
制取氯气并探究氯气是否具有漂白性 |
MnO2和稀盐酸 气体 气体 褪色 褪色 |
| C |
证明酸性条件H2O2氧化性比I2强 |
碘化钠溶液  溶液变蓝色 溶液变蓝色 |
| D |
探究浓度对于化学平衡的影响 |
FeCl3和KSCN混合溶液 红色变深 红色变深 |
某混合气体G可能含有CO、CO2、SO2、H2O等气体,用a.无水CuSO4、b.澄清石灰水、c.灼热CuO、d.碱石灰、e.品红溶液、f..酸性高锰酸钾溶液等药品可将其一一检出,检出的正确顺序是……()
| A.G→a→e→b→f→d→c | B.G→c→d→b→e→f→a |
| C.G→a→e→f→b→d→c | D.G→b→e→f→a→d→c |