【化学——选修2:化学与技术】工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入 (填设备名称),其主要目的是 。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图),其中a、c二步反应的化学方程式可表示为: 、 。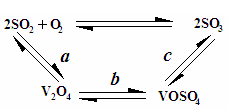
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(P)的关系如图所示,则:将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa,A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是: 。
(4)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣,查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图如下:
则反应①②③④中属于氧化还原反应的是 (填数字序号),反应①的离子方程式为 ,该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和度: 、 。
钠、镁、铁、铜及其化合物在科研和生产生活中有广泛的应用。
(1)Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,结构如图所示。电池工作时,正极的电极反应式 。常温下,用该电池电解200mL的饱和硫酸铜溶液(电极为惰性电极),反应时溶液中水的电离平衡移动(填“向左”“向右”或“不”);当消耗24mg金属Mg,电解后溶液的pH=(不考虑溶液的体积变化)。
(2)利用电解法在铁制品上镀铜可以防止铁被腐蚀,以下说法正确的是。
a.电镀时,铜和石墨都可以做阳极,可溶性铜盐作电解质溶液
b.电镀过程中,温度升高,电解反应速率加快
c.电镀过程中,电能全部转化为化学能
d.电镀过程中,铜离子向阴极移动,发生还原反应
(3)NaHS可作为沉淀剂除去溶液中的Cu2+。常温下,NaHS溶液显碱性,原因是(用离子方程式和必要的文字说明)。向含有Cu2+的废水中加入少量NaHS固体,废水溶液的pH(填“增大”“减小”或“不变”)。
菠萝酯是一种食用香料,是化合物甲与苯氧乙酸 发生酯化反应的产物。
发生酯化反应的产物。
(1)甲一定含有的官能团的名称是。
(2)5.8 g甲完全燃烧产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是。
(3)苯氧乙酸有多种酯类的同分异构体,写出其中能与FeCl3溶液发生显色反应,且苯环上只有两种一硝基取代物的所有可能的同分异构体的结构简式:
。
(4)已知:

菠萝酯的合成路线如下:
①试剂X不能选用的是(选填字母)。
a.CH3COONa溶液 b.NaOH溶液
c.NaHCO3溶液 d.Na
②丙的结构简式是,反应Ⅱ的反应类型是。
③反应Ⅳ的化学方程式是。
硼元素在化学中有很重要的地位。硼的化合物在农业、医药等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式________________________________________________________________________。
从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为________。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是________________________________________________________________________________________________________________________________________________。
(3)在BF3分子中中心原子的杂化轨道类型是________,SiF4粒子的空间构型是________。又知若有d轨道参与杂化,能大大提高中心原子成键能力。试解释为什么BF3、SiF4水解的产物中,除了相应的酸外,前者生成BF4-后者却是生成SiF62-:________________________________________________________________________
________________________________________________________________________。
(4)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图是该晶体微观空间中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的化学式为________。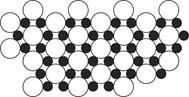
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有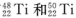 两种原子,它们互称为____。元素在元素周期表中的位置是第_____周期,第____族;基态原子的电子排布式为_____;按电子排布Ti元素在元素周期表分区中属于_____区元素。
两种原子,它们互称为____。元素在元素周期表中的位置是第_____周期,第____族;基态原子的电子排布式为_____;按电子排布Ti元素在元素周期表分区中属于_____区元素。
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是______,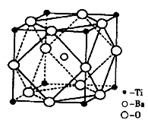
(3)氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金装饰的替代品。以TiCl4为原料,经过一系列反应,可以制Ti3N4和纳米TiO2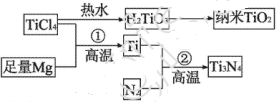 。
。
①Ti3N4中元素的化合价为_____。TiCl4分子中4个氯原子不在同一平面上,则TiCl4的空间构型为______。
②反应①为置换反应、该反应的化学方程式为______。
③纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如下: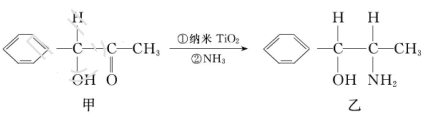
化合物甲的分子中采取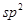 杂化的碳原子个数为_____,化合物乙中采取
杂化的碳原子个数为_____,化合物乙中采取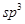 杂化的原子的第一电离能由大到小的顺序为_____。
杂化的原子的第一电离能由大到小的顺序为_____。
④有一种氮化钛晶体的晶胞如图所示,该氮化钛晶胞中含有______个N原子,晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为______g.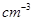 (NA为阿伏加德罗常数的数值,只列算式)。
(NA为阿伏加德罗常数的数值,只列算式)。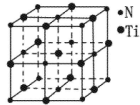
已知X元素原子的K、L层的电子数之和比L、M层的电子数之和多1个电子。Y元素的原子最外层电子数比内层电子数少3个。Z元素核外有3个电子层,最外层有3个电子。W元素最高化合价是最低化合价绝对值的3倍,它在最高价氧化物中的质量分数为40%。
(1)Y和W的气态氢化物的稳定性为(用化学式表示)>。
(2)X单质在空气中加热生成的化合物是化合物(填“离子”或“共价”)。
(3)X和Z的最高价氧化物对应水化物反应的离子方程式。
(4)W的低价氧化物与Y单质的水溶液反应的化学方程式。
(5)Y与Z形成化合物的化学式是。实验测得当此化合物处于固态和液态时不导电,溶于水能导电。由此判断该化合物具有键(填“离子”或“共价”)。