电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。下列叙述中正确的是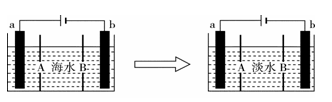
| A.A膜是阳离子交换膜 |
| B.通电后,海水中阴离子往b电极处运动 |
| C.通电后,a电极的电极反应式为4OH--4e-===O2↑+2H2O |
| D.通电后,b电极上产生无色气体,溶液中出现白色沉淀 |
X、Y是元素周期表ⅦA族中两种元素。下列叙述中能说明X的非金属性比Y强的是
| A.X原子的电子层数比Y原子的电子层数多 |
| B.X的氢化物的沸点比Y的氢化物的沸点低 |
| C.X的气态氢化物比Y的气态氢化物稳定 |
| D.Y的单质能将X从NaX的溶液中置换出来 |
关于键长、键能和键角,下列说法不正确的是( )
| A.键角是确定多分子立体结构(分子形状)的重要参数 |
| B.通过反应物和生成物分子中键能数据可以粗略预测反应热的大小 |
| C.键长越长,键能越小,共价化合物越稳定 |
| D.同种原子间形成的共价键键长长短总是遵循:叁键<双键<单键 |
下列叙述正确的是( )
A.同周期元素的原子半径以ⅦA族的为最大
B.在周期表中0族元素的单质全部是气体
C.ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子,第一电离能越大
D.所有主族元素的原子形成单核离子时的价数都和它的族数相等
X、Y、Z是周期表中相邻的三种短周期元素,它们原子半径依次减小,X与Z的核电荷数之比为3∶4,X、Y、Z分别与氢元素形成氢化物。下列叙述正确的是( )
| A.Z是第二周期IVA族元素 | B.最高价氧化物对应的水化物的酸性: Y﹥X |
| C.非金属性:X﹥Y﹥Z | D.X、Y、Z的氢化物稳定性逐渐减弱 |
关于化学键的叙述中,正确的是( )
| A.离子化合物可能含共价键 | B.共价化合物可能含离子键 |
| C.离子化合物中只含离子键 | D.离子化合物中一定含有金属离子 |