A、B、C、D、E五种短周期元素的原子序数依次增大,A和D,C和E分别同主族,E的原子序数为C的两倍,B的最外层电子数为A的最外层电子数的4倍。下列叙述正确的是
A.A、B、C三种元素形成的化合物一定是非电解质
B.A与C只能形成化学式为A2C的化合物
C.第三周期中,D的原子半径最大
D.E的氧化物对应的水化物一定具有强氧化性
关于元素周期表的说法正确的是
| A.第ⅠA族的元素都为金属元素 |
| B.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C.过渡元素全部是金属元素 |
| D.周期表中有7个主族,7个副族,一个0族,一个VIII族,共16个族16个纵行 |
下列各物质中属于纯净物的是
①水玻璃 ②水泥 ③普通玻璃 ④漂白粉 ⑤Na2CO3·10H2O ⑥氯水 ⑦液氯 ⑧纯净的盐酸
| A.⑤⑦ | B.①⑤⑦⑧ | C.①⑤⑥ | D.①④ |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生如下反应:A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化关系如图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化关系如图所示。下列说法中正确的是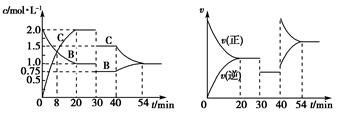
| A.反应方程式中的x=1, 30min时改变条件后,A的转化率将变减小 |
| B.前30 min内 A的反应速率为0.05 mol/(L·min) |
| C.20至40 min内表示处于平衡状态,该反应为放热反应 |
| D.30 min时改变的条件是加入负催化剂,40 min时改变的条件是升高温度 |
已知2SO2(g)+ O2(g) 2SO3(g)△H=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3;恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3(g)△H=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3;恒温、恒容下反应达平衡时,下列关系一定正确的是
| A.容器内压强p:p甲=p丙<2p乙 |
| B.SO3的质量m:m甲=m丙<2m乙 |
| C.c(SO2)与c(O2)之比k:k甲=k丙>k乙 |
| D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙 |
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1mol H2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1mol H2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
| A.容器I、II中正反应速率相同 |
| B.容器I、III中反应的平衡常数相同 |
| C.容器I中CO的物质的量比容器II中的多 |
| D.容器I中CO的转化率与容器II中CO2的转化率之和等于1 |