【化学——选修3:物质结构与性质】(15分)有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)D的元素符号为______。A的单质分子中π键的个数为______。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是___________________。
(3)A、B、C 3种元素的第一电离能由大到小的顺序为________(用元素符号表示)。
(4)写出基态E原子的价电子排布式:__________________。
(5)A的最简单氢化物分子的空间构型为________,其中A原子的杂化类型是________。
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用ρ、NA的计算式表示)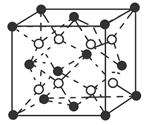
N2(g)+3H2(g)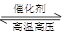 2NH3(g)△H<0。当反应达到平衡时,下列措施能提高N2转化率的是
2NH3(g)△H<0。当反应达到平衡时,下列措施能提高N2转化率的是
① 降温② 恒压通入惰性气体③ 增加N2的浓度④ 加压
| A.①④ | B.①② | C.②③ | D.③④ |
关于0.1mol·L-1NaHCO3溶液,下列说法正确的是
A.溶质水解反应:HCO3- +H2O H3O++CO32- H3O++CO32- |
| B.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| C.微粒浓度关系:c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-) |
| D.微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)] |
下列事实对应的化学用语正确的是
| A.金属钠加入滴有酚酞的水中,溶液变红:Na+ 2H2O=Na+ + 2OH- + H2↑ |
| B.用NaOH溶液吸收多余的氯气:Cl2 + 2OH- =Cl- + ClO-+ H2O |
| C.将NaHCO3溶液和过量Ca(OH)2溶液混合有白色沉淀:2HCO3-+Ca2++2OH-=CaCO3↓+ 2H2O + CO32- |
| D.将醋酸溶液滴到大理石上有气泡产生:2H+ + CaCO3=CO2↑+ Ca2+ + H2O |
下列变化必须加入氧化剂才能实现的是
| A.Cr2O72-→CrO42- | B.HNO3 →NO2 |
| C.SiO2 →Si | D.CH3CH2OH→CH3CHO |
下列说法正确的是
| A.2-甲基丙烷的一氯取代物有两种 |
B. 和 和 互为同系物 互为同系物 |
| C.顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同 |
D.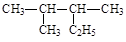 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 |