为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:①KSCN溶液 ②NaOH溶液 ③酸性KMnO4溶液 ④K3[Fe(CN)6]溶液。
(1)请完成下表:
| 操作 |
现象 |
结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 |
|
存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴 (填序号)溶液,振荡 |
|
存在Fe2+ |
【实验结论】Fe的氧化产物为Fe2+和Fe3+
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
(2)装置B的作用是 。
(3)经小组讨论并验证该无色气体为O2,其操作方法是 。
(4)【查阅资料】①Ag2O和粉末的Ag均为黑色;②Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:①Ag;②Ag2O;③Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验:
| 实验编号 |
操 作 |
现 象 |
| a |
加入足量氨水,振荡 |
黑色固体不溶解 |
| b |
加入足量稀硝酸,振荡 |
黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是 (填实验编号)。
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的化学方程式为 。
【实验拓展】另取2.0g AgNO3样品充分受热分解,共收集到标准状况下气体的体积为336mL,则样品中AgNO3的百分含量为 。
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法: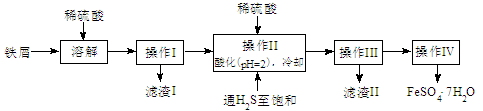
查询资料,得25℃时有关物质的数据如下表:
| 饱和H2S溶液 |
SnS沉淀完全 |
FeS开始沉淀 |
FeS沉淀完全 |
|
| pH值 |
3.9 |
1.6 |
3.0 |
5.5 |
(1)操作II中,先通入硫化氢至饱和,目的是 ;后加入硫酸酸化至pH=2的作用是 。
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;② 。
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①已知酸性KMnO4被FeSO4还原时生成Mn2+。写出该测定过程的离子反应方程式 ;
②滴定时盛放KMnO4溶液的仪器为 (填仪器名称)。
③判断此滴定实验达到终点的方法是 。
④若实验操作无失误,测得上述样品中FeSO4·7H2O的含量仍偏低,则可能的原因是 。
某研究性学习小组选用以下装置进行实验设计和探究(图中a、b、c均为止水夹)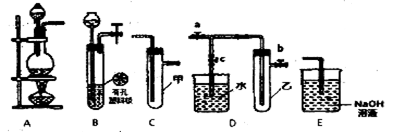
(1)在进行气体制备时,应先检验装置的气密性。将A装置末端导管密封后,在A装置的分液斗内装一定量的蒸馏水,然后________ ,则证明A装置的气密性良好。
(2)用锌粒和稀硫酸制各H2时应选用装置____作为发生装置(填所选装置的序号字母),实验时可先在稀硫酸溶液中加入少型硫酸铜晶体会使反应速率加快,原因是 。
(3)某同学利用上述装置设计实验证明Cl2氧化性强于Br2
①选用的装置连接顺序为:()→()→()(填所选装置的序号字母):
②从以下试剂中选用该实验所需的试剂为 ____(填试剂的序号字母):
a.浓硫酸
b.浓盐酸
c.二氧化锰
d.氯化钠
e.溴化钠溶液
③实验过程中能说明Cl2氧化性强于Br2的实验现象是 ________ ;
(4)另-同学将B、D、E装置连接后,茬套囊璧中加入铜片和浓硝酸,制取NO2,然后进行NO2气体与水反应的实验,并观察相关现象:
①B装置发生反应的离子方程式为____________________;
②反应一段时间后D装置中的具支试管乙中收集满NO2气体,若进行NO2气体与水反应的实验,应 (填“对a、b、c三个止水夹进行的操作”),然后再适当加热乙。
③E装置中的NaOH溶液可吸收尾气NO2,反应生成NaNO3、NaNO2和H2O,反应中生成的NaNO3和NaNO2的物质的量之比为 。
某同学设计了以下操作流程来除去混在氯化钠固体中的少量硫酸钠和氯化钙。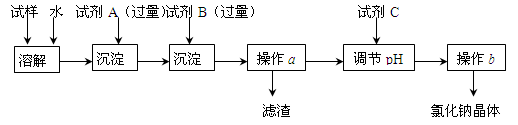
(1)试剂A是 ,试剂A需要过量的原因是 。
(2)操作a得到的滤渣的成分是 ,在实验室中进行操作a需要的仪器是:铁架台(带铁圈)、滤纸、烧杯、 、 。
(3)加入试剂C调节滤液pH的离子反应方程式是 。
(4)该同学想利用上述得到的氯化钠设计一套实验装置来电解饱和食盐水,并检验氯气的氧化性和测定所产生的氢气的体积,部分装置如下图: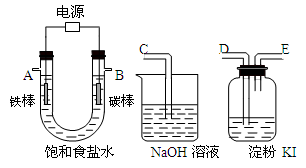
①碳棒接直流电源的_____极; 铁棒上发生的电极反应为 ________________ 。
②说明氯气具有氧化性的实验现象是 ____________ 。
③将上图中的仪器,连成一整套装置,各种仪器接口连接顺(填编号)是B接 ,
接 。在答题卡的方框中画出与A接口连接的仪器的装置图。
用下图装置进行 转化为
转化为 的转化率测定实验:
的转化率测定实验:


 。已知:
。已知:
熔点(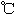 ) ) |
沸点(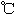 ) ) |
|
 |
-72.4 |
-10 |
 |
16.8 |
44.3 |

(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接合适的装置(可重复使用),请从下列A~E中选择适宜的装置,将其序号填入空格内。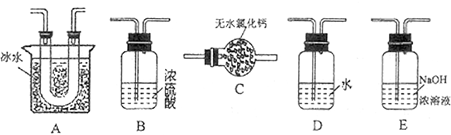
(2)将装置连接好,实验前,必须进行的操作是(不必写具体过程) 。
(3)实验时,浓硫酸有顺利滴入烧瓶中,甲装置所起作用的原理是 。
(4)开始实验时,先从乙处均匀通入 ,为使
,为使 有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 。
有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 。
(5)实验中“当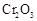 表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是 ;若用大火加热有
表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是 ;若用大火加热有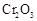 处的反应管时,
处的反应管时, 的转化率会 (填“升高”、“降低”或“不变”)。
的转化率会 (填“升高”、“降低”或“不变”)。
(6)实验时若用25.2g的 ,加入的浓硫酸是足量的,反应结束时继续通入
,加入的浓硫酸是足量的,反应结束时继续通入 一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中
一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中 的转化率为 %(保留小数点后一位)。
的转化率为 %(保留小数点后一位)。
某课外活动小组设计了如下图所示的装置,调节滑动变阻器,控制电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,止水夹a处于打开状态,止水夹b处于关闭状态)。实验过程中看到了令人很高兴的现象(阳离子交换膜只允许阳离子和水通过)。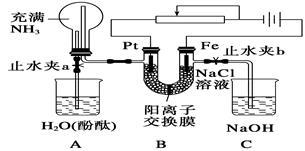
请帮助他们分析并回答下列问题:
(1)写出B装置中的电极反应:
阴极:__________________________________;
阳极:__________________________________。
(2)先后观察到A装置中的现象是:
①烧杯A中导管产生气泡数秒后溶液变红, ;
②烧瓶中液面 ______________________________,烧杯A中导管又有气泡冒出。
(3)当观察到A装置中的现象后,他们关闭止水夹a,打开止水夹b。再观察C装置(此溶液经过煮沸,且上层有油膜),若无现象,请说明理由;若有现象,请写出有关反应的化学方程式(是离子反应的写离子方程式):_______________________;片刻后再向烧杯C 中吹大量空气,则C中的现象是 。