下列对有关物质性质的分析正确的是
| A.Na久置于空气中,最终生成NaHCO3, |
| B.在高温下用氢气还原AlCl3可制取金属铝 |
| C.SiO2与焦炭反应,再经化学提纯得高纯硅 |
| D.N2在放电条件下与O2反应生成NO2 |
将硫酸铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则原硫酸铝溶液和氢氧化钠溶液的物质的量之比可能是①1∶3 ②2∶3 ③1∶7 ④2∶7 ⑤任意比
| A.②③ | B.只有① | C.②④ | D.①③ |
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32−、SO42−、NO3−中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。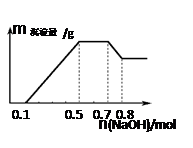
则下列说法正确的是
| A.溶液中的阳离子只有H+、Mg2+、Al3+ |
| B.溶液中n(NH4+)=0.2mol |
| C.溶液中一定不含CO32−,可能含有SO42−和NO3− |
| D.三种离子的物质的量之比:n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1 |
1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质为
| A.Na2CO3 | B.Na2O2、Na2CO3 |
C.NaOH、Na2CO3 | D.Na2O2、NaOH、Na2CO3 |
已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色的溶液,其离子方程式是:PbSO4+2Ac-=Pb(Ac)2+SO42-。当Pb(Ac)2(醋酸铅)水溶液中通入H2S时,有黑色沉淀PbS和弱电解质HAc生成。表示这个反应的有关离子方程式正确的是 (注:Ac—表示醋酸根)
| A.Pb(Ac)2+H2S = PbS↓+2HAc | B.Pb2++H2S = PbS↓+2H+ |
| C.Pb2++2Ac-+H2S = PbS↓+2HAc | D.Pb2++2Ac-+2H++S2- =PbS↓+2HAc |
我校化学兴趣小组做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。则该条件下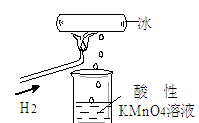
| A.生成的水分子化学性质比较活泼 |
| B.H2燃烧生成了具有氧化性的物质 |
| C.H2燃烧的产物中可能含有一定量的H2O2 |
| D.H2被冷却为液态氢,液氢的水溶液具有还原性 |