下列说法正确的是
| A.在化学反应中某元素由化合态变为游离态,该元素一定被还原 |
| B.失电子难的原子其得电子的能力一定强 |
| C.电子层结构相同的各种离子,它们的半径随核电荷数的增加而减小 |
| D.最外层电子数较少的金属元素,一定比最外层电子数较它多的金属元素活泼 |
化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是
| A.N2(g)+3H2(g)=2NH3(l);ΔH=2(a-b-c) kJ·mol-1 |
| B.N2(g)+3H2(g)=2NH3(g);ΔH=2(b-a) kJ·mol-1 |
C. N2(g)+ N2(g)+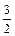 H2(g)=NH3(l);ΔH=(b+c-a) kJ·mol-1 H2(g)=NH3(l);ΔH=(b+c-a) kJ·mol-1 |
D. N2(g)+ N2(g)+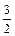 H2((g)=NH3(g);ΔH=(a+b) kJ·mol-1 H2((g)=NH3(g);ΔH=(a+b) kJ·mol-1 |
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
| A.a电极是负极 |
| B.b电极的电极反应为:4OH--4e-=2H2O+O2 |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为
A.A>B>E>D B.A>B>D>E C.D>E>A>B D.D>A>B>E
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g) 2NH3(g),△H< 0
2NH3(g),△H< 0
673K,30MPa下n(NH3)和n(H2)随时间变化的关系
如下图所示。下列叙述正确的是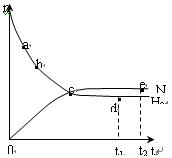
| A.点a的正反应速率比点b的大 |
| B.点 c处反应达到平衡 |
| C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样 |
| D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值小 |
反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2→2HCl的反应速率v=k(CH2)m(CCl2)n,式中k为常数,m、n值可用下表中数据确定。由此可推得的m、n值正确的是
| CH2 (mol·L-1) |
CCl2 (mol·L-1) |
v(mol·L-1·s-1) |
| 1.0 |
1.0 |
1.0k |
| 2.0 |
1.0 |
2.0k |
| 2.0 |
4.0 |
4.0k |
| A.m=1,n=1 | B.m=1/2,n=1/2 |
| C.m=1/2,n=1 | D.m=1,n=1/2 |