锗(Ge)是第四周期第 Ⅳ A 元素,处于周期表中金属区与非金属区的交界线上,下列叙述正确的是
| A.锗是一种金属性很强的元素 | B.锗的单质具有半导体的性能 |
| C.锗化氢(GeH4)稳定性比CH4强 | D.锗酸(H4GeO4)是难溶于水的强酸 |
对水的电离平衡不产生影响的粒子是
| A.Al3+ | B.CH3COOH | C.K+ | D.HCl |
0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度关系正确的是
| A.c(NH4+)+ c(H+) =c(OH-) |
| B.c(Na+)=c(Cl-)>c(H+)=c(OH-) |
| C.c(NH4+)+c(NH3·H2O) =2c(Cl-) |
| D.c(NH4+) >c(NH3·H2O)>c(OH-)>c(H+) |
列各组离子一定可以大量共存的是
A.在含大量Al3+的溶液中:NH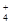 、Na+、HCO3-、SO42- 、Na+、HCO3-、SO42- |
| B.能使甲基橙试液变红的溶液中:Na+、K+、MnO4-、NO3- |
C.在水电离出的c(H+) =10-13mol·L-1的溶液中:NH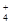 、[Al(OH)4]-、SO 、[Al(OH)4]-、SO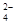 、NO 、NO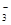 |
| D.在pH=1的溶液中: K+、Fe2+、Cl-、NO2- |
汽车上用的铅蓄电池是以一组充满海绵状态的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。总反应为:Pb+PbO2+2H2SO4 2PbSO4+2H2O,下列叙述正确的是
2PbSO4+2H2O,下列叙述正确的是
| A.充电时阴极反应为:Pb + SO42- -2e- =PbSO4 |
| B.放电时,当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为1mol |
| C.放电时溶液中H+向负极移动 |
| D.充电时阳极附近溶液的pH减小 |
为了除去氯化镁酸性溶液中的Fe3+离子,可在加热搅拌下加入一种试剂,过滤后再加入适量盐酸。这种试剂是
| A.稀氨水 | B.氢氧化钠 | C.碳酸镁 | D.碳酸钠 |