(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10—1 |
1.8×10—5 |
4.9×10—10 |
K1=4.3×10—7 K2=5.6×10—11 |
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为 (填序号)。
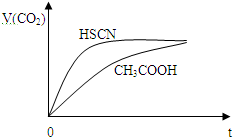
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO—) c(SCN—)(填“>”、“<”或“=”)
③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。
a.c(CH3COO-) b.c(H+)
c.Kw d.醋酸电离平衡常数
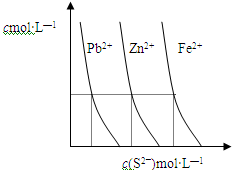
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:

请回答:
①甲烷燃料电池的负极反应式是 。
②当线路中有0.1 mol电子通过时, 极增重________g
污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等。
⑴为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
写出焦炭与水蒸气反应的热化学方程式______________________。
该反应的平衡常数表达式为K=_________。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是________(选填序号)。
a.Ca(OH)2 b.CaCl2c.Na2CO3 d.NaHSO3
⑵为了减少空气中的CO2,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用(NH4)2CO3,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq),ΔH3
为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图,则: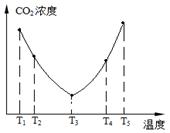
①ΔH3____0(填“>”、“=”或“<”)。
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的可能原因有:___________________________;__________。
氯气在生产生活中应用广泛。
(1)多余的氯气可用NaOH溶液吸收,反应的离子方程式为。工业上也可用MnSO4溶液吸收氯气,获得Mn2O3,Mn2O3广泛应用于电子工业、印染工业等领域。请写出该化学反应的离子方程式。
(2)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2 。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
①步骤I中,试剂甲必须具有的性质是(填序号)。
A.氧化性B.还原性C.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL ,该反应的离子方程式为。
(3)用100 mL 12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30 mol,请你分析可能的原因为。
实验室常用的浓盐酸物质的量浓度约为12.0mol·L-1。
(1)实验室欲用上述浓盐酸配制480mL 0.20mol·L—1的稀盐酸溶液,则需要取上述浓盐酸mL。
(2)配制过程中,不需要的仪器(填写代号)。
A.药匙 B.胶头滴管 C.玻璃棒D.烧杯
完成实验还缺少的仪器是、。
(3)取用任意体积的所配0.20 mol·L-1 HCl溶液时,下列物理量中不随所取体积的多少而变化的是(填字母)
A.溶液中HCl的物质的量B.溶液的浓度
C.溶液中Cl—的数目 D.溶液的密度
(16分)已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z的气态氢化物能与其最高价氧化物的水化物反应,G是地壳中含量最高的金属元素。
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) 。
(2)Z在元素周期表中的位置为 。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) 。
(4)常温下,不能与G的单质发生反应的是(填序号) 。
a.CuSO4溶液 b.Fe2O3c.浓硫酸d.NaOH溶液e.Na2CO3固体
(5)已知化合物C含有下述元素中的某一种元素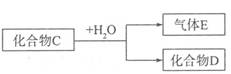
①若D是一种强酸,则C与水反应的化学方程式为 。
有人认为“浓H2SO4可以干燥气体C”,某同学为了验证该观点是否正确,用如图装置进行实验.分液漏斗中应加入 ,打开分液漏斗进行实验,过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的解释和结论是 。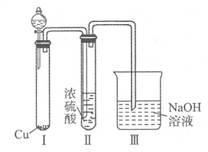
②若D是一种常见的强碱,则C与水反应的离子方程式为 。
(13分)雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某兴趣小组收集了该地区的雾霾,试样溶液经必要的预处理后,设计并完成了如下的实验:
已知:NO3-+A1+OH-+H2O→NH3↑+[Al(OH)4]-,根据以上的实验操作与现象,回答下列问题:
(1)气体l的成分可能是 ,进一步确定该气体成分的方法是 ,
实验室制备该气体的方程式为 。
(2)写出沉淀2产生气体的离子方程式 。
(3)经过以上实验可知,该地区雾霾中一定存在的离子有 。
(4)某同学采用了另外一种实验方法,取少量的试样直接加入硝酸银溶液产生白色沉淀,该同学由此就确定一定含有Cl-,你认为他的说法是否合理 (填是或否),其理由是 。