下列各选项陈述I和陈述II均正确且二者有因果关系的是
| |
陈述I |
陈述II |
| A |
常温下铁、铜均不溶于浓硝酸 |
常温下铁与浓硝酸发生钝化;铜与浓硝酸不反应 |
| B |
HCl与Na2SO3溶液反应生成SO2 |
用饱和Na2SO3溶液除去SO2中的少量HCl |
| C |
氨气液化时吸热 |
氨气常用作制冷剂 |
| D |
明矾和漂白粉常用于自来水的净化和杀菌消毒 |
两者的作用原理不同 |
下列说法中正确的是
| A.镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池 |
| B.燃料电池是一种高效但是会污染环境的新型电池 |
| C.化学电池的反应基础是氧化还原反应。 |
| D.铅蓄电池放电的时候正极是Pb ,负极是PbO2 |
最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如下图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2H2O+2e-="==" 2MnO(OH)+2OH-
F极:Zn+2NH4Cl -2e-===Zn(NH3)2Cl2+2H+
总反应式:2MnO2+Zn+2NH4Cl ="==" 2MnO(OH)+Zn(NH3)2Cl2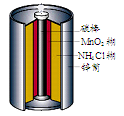
下列说法正确的是
| A.E极是电池的正极,发生的是氧化反应 |
| B.F极是电池的负极,发生的是氧化反应 |
| C.从结构上分析,锌锰电池应属于可充电电池 |
| D.锌锰电池内部发生的氧化还原反应是可逆的 |
下列烧杯中盛放的都是稀硫酸,不能构成原电池的是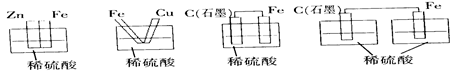
A B C D
将纯锌片和纯铜片按图示方式插入同浓度同体积的稀硫酸中一段时间,以下叙述正确的是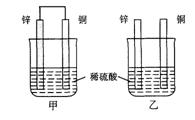
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程中正确的是
| A.1/2 N2H4(g)+ 1/2 O2(g)= 1/2 N2(g)+ H2O(l)△H=+257kJ·mol-1 |
B.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-133.5kJ·mol-1 |
C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJ·mol-1 |
D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ·mol-1 |