氨气在科研、生产中有广泛应用。
(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g) 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。

①实验Ⅲ在前10分钟内NH3平均反应速率v(NH3)= ;
②与实验Ⅱ相比,实验Ⅲ采用的实验条件可能为 。
③K(T1)___K(T2)(填“>”、“=”或“<”)。
④下图表示随条件改变,平衡体系中氨气体积分数的变化趋势。当横坐标为压强时,变化趋势正确的是(填序号,下同)__________,当横坐标为温度时,变化趋势正确的是___________。

(2)常温下NH3•H2O的电离平衡常数Kb=1.8×10-5 mol·L-1,则反应NH4+(aq)+H2O(l) NH3•H2O(aq)+H+(aq)的化学平衡常数Kh= (保留三位有效数字)。
NH3•H2O(aq)+H+(aq)的化学平衡常数Kh= (保留三位有效数字)。
(3)工业上用NH3消除NO污染。在一定条件下,已知每还原1molNO,放出热量120kJ,请完成下列热化学方程式: NO(g)+ NH3(g)= N2(g)+ (g) ΔH2= 。
下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
已知:
①反应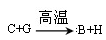 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和 可以发生反应:2E+I
可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为________________________________;
(2)化合物Ⅰ的电子式为______________________,它的空间构型是_________;
(3)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量______________________;
(4)C与过量NaOH溶液反应的离子方程式为_______________________,反应后溶液与过量化合物Ⅰ反应的离子方程式为_______________________;
(5)E在I中燃烧观察到的现象是______________________。
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为。
(2)上述反应中的氧化剂是,反应产生的气体可用吸收。
(3)As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O若生成2mol H3AsO4,则反应中转移电子的物质的量为。若将该反应设计成一原电池,则NO2应该在(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量(选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,它的分子式为C10H10O2。G为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示(图中球与球之间连线表示单键、双键等)。
以芳香烃A为原料合成G的路线如下:
①化合物E中的官能团为 __________________________(填名称)。
②E→F的反应类型是_______________________-。
③写出下列化学方程式
C→D_______________________________________________________;
E→H_______________________________________________________。
下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C。 H可用作工业上冶炼金属的还原剂。请按要求填空:
(1)写出下列物质的化学式:A:________;B:________;C:________.
(2)写出F+B→I的化学方程式_________________________________.
(3)写出G和I的浓溶液反应的化学方程式_________________________
Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:(1)氮元素原子的L层电子数为__________;
(2) NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为_________________________;
(3) 肼-空气燃料电池是一种碱性电池,该电池放电时,正极的反应式为________________________________。
Ⅱ、一定质量的液态化合物XY2在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为: XY2(l)+3O2 (g) ="==" XO2(g)+2YO2 (g)冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56g/L则: (1)反应前O2的体积是________。(2)化合物XY2的摩尔质量是___________。
(3)XY2分子中X、Y两元素质量比是3∶16, X、Y两元素分别为__________ (写元素符号)。