近几年科学家发明的一种新型可控电池——锂水电池,工作原理如图所示。下列有关说法正确的是
| A.碳极发生氧化反应 |
| B.有机电解质和水溶液不可以互换区域 |
| C.Li电极电极反应式为Li++e-=Li |
| D.若电源工作时产生标准状况下1.12 LH2,则有0.1mol电子通过有机电解质传递到正极 |
合成氨的反应为:3H2 + N2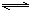 2NH3,其反应的速率可分别表示为v(H2)、v(N2)、v(NH3)(单位为mol·L-1·s-1),则下列关系正确的是
2NH3,其反应的速率可分别表示为v(H2)、v(N2)、v(NH3)(单位为mol·L-1·s-1),则下列关系正确的是
| A.v(H2)=v(N2)= v(NH3) | B.v(H2)=3 v(N2) |
| C.v(N2)=2 v(NH3) | D.v(NH3)=3/2v(H2) |
下列说法中正确的是
| A.反应热就是反应中放出的热量 |
| B.在101KPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
| C.由C(石墨,s)=C(金刚石,s)ΔH=+1.9kJ/mol,可知金刚石比石墨稳定 |
| D.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
已知某可逆反应:mA(g)+nB(g)  pC(g);△H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
pC(g);△H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
| A.T1<T2,P1>P2,m+n>p,△H>0 |
| B.T1>T2,P1<P2,m+n>p,△H>0 |
| C.T1>T2,P1<P2,m+n<p,△H<0 |
| D.T1>T2,P1>P2,m+n>p,△H<0 |
对于反应2C4H10(g) + 13O2(g) ="=" 8CO2(g) + 10H2O(l);△H= -5800kJ/mol,下列叙述错误的是
| A.该反应的反应热为△H= -5800kJ/mol,是放热反应; |
| B.该反应的△H与各物质的状态有关,与化学计量数也有关; |
| C.该式的含义为:25℃、101kPa下,2mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ; |
| D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol。 |
已知常温时红磷比白磷稳定,在下列反应中:
4P(白磷,s)+5O2(g)====2P2O5(s);△H= -a kJ/mol
4P(红磷,s)+5O2(g)====2P2O5(s);△H= -b kJ/mol
若a、b均大于零,则a和b的关系为
| A.a<b | B.a=b | C.a>b | D.无法确定 |