亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
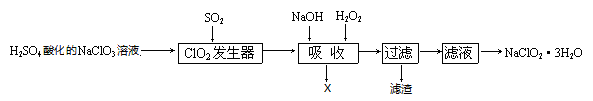
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
请回答下列问题:
(1)发生器中反应的化学方程式为 ;为了增加生产的安全性在发生器中还需要进行的操作为 。
(2)吸收塔产生的气体X为 (化学式)。
(3)吸收塔的温度不能超过20℃,原因是 。
(4)滤渣的成分为 (化学式)。
(5)从滤液中得到NaClO2•3H2O晶体需要洗涤,为了减少溶解损失可以用 洗涤NaClO2•3H2O晶体。
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)______________.
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为_____________,____________;与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)______________.
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体应是(填化学式)____________.
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为_____________,请设计实验检验所得溶液中溶质的阴离子______________.
常温下有浓度为0.1mol/L、体积为VL的氨水,向其中逐滴加入一定浓度的盐酸,得到如图的滴定曲线,其中d点时两种溶液恰好完全反应。根据图像回答下列问题:
(1)上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH如下表,请将表格补充完整:
| 离子浓度大小顺序 |
溶质化学式 |
溶液的pH |
| c (NH4+)>c (OH-)>c (CI-)>c (H+) |
① |
>7 |
| ② |
③ |
=7 |
| ④ |
NH4Cl |
⑤ |
(2)该温度时氨水的电离平衡常数K数值约为____________。滴定过程中所用盐酸的pH=____________。
(3)若取该实验中恰好完全反应的d点溶液,向其中滴加0.1VL某浓度的氨水后溶液呈中性,依(2)中计算结果计算所滴加氨水的浓度为____________ moI/L。
(1)某课外活动小组同学用图1装置(M、N为外电源的两个电极)进行实验,试回答下列问题:
①若开始时开关K与a连接,则铁发生电化学腐蚀中的_________腐蚀。请写出正极反应式:____________。
②若开始时开关K与b连接时,两极均有气体产生,则铁电极为__________极(填“阴”或“阳”),该电极上发生的电极反应式为_____________,总反应的离子方程式为________________。
(2)该小组同学设想,用如图2所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠。
①B出口导出的气体是__________,制得的氢氧化钠溶液从出口____________(填“A”、“B”、“C”或“D”)导出。通过阴离子交换膜的离子数____________(填“>”、“<”或“=”)通过阳离子交换膜的离子数。
②氢气、氧气和氢氧化钠溶液又可制成燃料电池,该电池的负极反应式为__________________。
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:
①甲烷燃料电池负极的电极反应为________________________。
②闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是____________(填化学式),电解氯化钠溶液的总反应方程式为_________________________;
③若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为__________(法拉第常数F=9.65×104 C · mol-1,列式计算),最多能产生的氯气体积为__________L(标准状况)。
在苹果、香蕉等水果的果香中存在着乙酸正丁酯。某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯。实验步骤如下:
(一)乙酸正丁酯的制备
①在干燥的50mL圆底烧瓶中,加入13.5mL(0.15mol)正丁醇和7.2mL(0.125mol)冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石。
按下图所示安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口。
②打开冷凝水,圆底烧瓶在石棉网上用小火加热。在反应过程中,通过分水器下部的旋塞不断分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中。反应达到终点后,停止加热,记录分出的水的体积。
(二)产品的精制
③将分水器分出的酯层和反应液一起倒入分液漏斗中,先用10 mL的水洗涤,
再继续用10 mL10%Na2CO3洗涤至中性,再用10 mL 的水洗涤,最后将
有机层转移至锥形瓶中,再用无水硫酸镁干燥。
④将干燥后的乙酸正丁酯滤入50 mL 烧瓶中,常压蒸馏,收集124~126℃的
馏分,得11.6g产品。
(1)写出该制备反应的化学方程式_______________。
(2)冷水应该从冷凝管___________(填a或b)管口通入。
(3)步骤②中不断从分水器下部分出生成的水的目的是__________________。步骤②中判断反应终点的依据是_______。
(4)产品的精制过程步骤③中,洗的目的是______________________。两次洗涤完成后将有机层从分液漏斗的__________置入锥形瓶中。