工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO + 2Cl- + 4H+ = 2ClO2↑+ Cl2↑+ 2H2O。
(1)写出第二步反应的离子方程式 。
(2)工业生产时需在反应物中加少量Cl-,其作用是 。
(3)生产中会发生副反应ClO + Cl- + H+ - Cl2↑+ H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为3/73,则起始投料时CH3OH与NaClO3的物质的量之比为 。
(写出解题过程)
.(8分)在如下的转化关系中,已知有机物A是一种邻位二取代苯,其中一个取代基是羧基:
请回答下列问题:
(1)反应①,②都属于取代反应。其中①是_________反应,②是_________反应(填有机反应名称)。
(2)A的结构简式是:
______________________________________________________。
(3)反应③的化学方程式是(有机物写结构简式):
______________________________________________________。
(4)写出A与NaOH溶液共热的化学方程式(有机物写结构简式):
______________________________________________________。
(5)写出三种具有与A相同官能团且均为邻位二取代苯的同分异构体的结构简式:
______________,______________,_____________
夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。下图是北京鸟巢试放烟火奥运五环图,并回答下列问题:
(1)火焰利用了部分金属的元素特征的 反应,该反应属于 (填“物理”或“化学”变化。)
(2)现在有一种火焰的引发是当浓H2SO4滴下去跟氯酸钾起作用时,便生成了奇臭的二氧化氯气体且发现只有氯元素的化合价发生变化。请写出该反应的方程式
(3)下图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为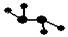 ,C、D均为原子晶体,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C、D均为原子晶体,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题: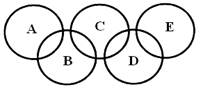
①B的水溶液呈弱酸性,其主要的电离方程式可表示为__________________,D的化学式是_________。
②A、B、E中均含有的一种元素符号为______________。
③C与纯碱反应的化学方程式为____________________。
④液态B与液态E反应可生成一种单质和一种常见液体,1molB参加反应放出热量QkJ,其反应的热化学方程式为_______________________。
2009年8月,陕西省凤翔县长青镇马道口村和邻村孙家南头村的村民们自发到宝鸡各大医院检测发现,两村数百名婴幼儿及儿童绝大多数被检测出体内铅含量超标,其中部分超标严重,已达到中毒标准。两村民居南北环抱着的一家年产铅锌20万吨的冶炼企业,被疑与此有关。
(1)铅(原子序数为82)位于元素周期表的 周期 族,已知+2价铅比+4价铅稳定,+4价铅有较强的氧化性。将PbO2与浓盐酸加热反应产生黄绿色的气体,写出该反应的离子方程式 ,将SO2通入棕色PbO2的悬浊液中会产生白色沉淀,写出该反应的化学方程式 。
(2)铅锭冶炼厂采用火法冶炼铅,铅在自然界中以方铅矿(PbS)的形式存在,主要生产过程是先煅烧方铅矿制成PbO,再用CO还原PbO制备铅。上述生产过程中的主要化学方程式为 、 。
(3)铅蓄电池是典型的可充电型电池,它的正负极板是惰性材料,电池总反应式为: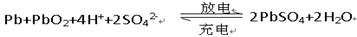 。放电时正极的电极反应式是 ;电解液中H2SO4的浓度将(填“变大”“变小”或“不变“);当外电路通过电子2mol时,理论上负极板的质量增加 g。
。放电时正极的电极反应式是 ;电解液中H2SO4的浓度将(填“变大”“变小”或“不变“);当外电路通过电子2mol时,理论上负极板的质量增加 g。
(4)铅在工业中应用广泛,如为了增强彩釉的亮度,陶瓷业在釉中常加入少量的铅。铅在酸性溶液中容易溶解,生成+2价铅进入人体,写出铅“吃醋”的化学方程式: 。汽车工业为提高发动机的使用寿命,常在汽油中加入抗震剂四乙基铅的分子式: 。
(7分)用乙醛还原新制备的Cu(OH)2可以生成红色的Cu2O沉淀。再加入过量的乙酸,使Cu2O发生歧化反应生成Cu2+和Cu,新生成的细小的晶体铜分散在溶液中即形成黄绿色透明铜溶胶。试写出表示以上反应过程的化学方程式。
(1) 。
(2) 。
(3)怎样证明新制得的分散系是胶体?
。
(7分)用乙醛还原新制备的Cu(OH)2可以生成红色的Cu2O沉淀。再加入过量的乙酸,使Cu2O发生歧化反应生成Cu2+和Cu,新生成的细小的晶体铜分散在溶液中即形成黄绿色透明铜溶胶。试写出表示以上反应过程的化学方程式。
(1)。
(2)。
(3)怎样证明新制得的分散系是胶体?
。