【物质结构与性质】有A、B、C、D、E五种元素(A、B、C、D、E分别代表元素符号),其中A元素原子核内只有一个质子;B元素的基态原子s亚层的总电子数比p亚层的总电子数多1;C元素的原子最外层电子数是次外层电子数的3倍;D位于B的下一周期,在同周期元素形成的简单离子中,D形成的简单离子半径最小;E的基态原子中电子排布在三个能级上,且这三个能级所含电子数均相同。
(1)A、E形成的化合物E2A4每个分子中 键和
键和 键数目之比为________,B、C、E三种元素的第一电离能由大到小的顺序为_________,电负性由大到小的顺序为________(用实际元素符号表示)。
键数目之比为________,B、C、E三种元素的第一电离能由大到小的顺序为_________,电负性由大到小的顺序为________(用实际元素符号表示)。
(2)BA3易液化的主要原因是__________________。 离子中B原子轨道的杂化类型为__________,离子空间构型为 。
离子中B原子轨道的杂化类型为__________,离子空间构型为 。
(3)写出D元素基态原子的核外电子排布式______________。
(4)E的一种单质晶胞结构如图,晶胞的边长为 。该晶体的密度为________
。该晶体的密度为________ g(NA表示阿伏加德罗常数,E的相对原子质量为b)。
g(NA表示阿伏加德罗常数,E的相对原子质量为b)。

尼泊金甲酯和香兰素在食品、化妆品行业有广泛用途。它们的结构简式如下: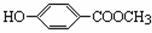 (尼泊金甲酯)
(尼泊金甲酯) (香兰素)
(香兰素)
(1)尼泊金甲酯中显酸性的官能团是 (填名称)。
(2)下列说法中,正确的是 (填标号)。
| A.尼泊金甲酯和香兰素分子式都是C8H8O3 |
| B.尼泊金甲酯和香兰素都能发生水解反应 |
| C.1mol尼泊金甲酯或香兰素均能与4mol H2发生加成反应 |
| D.利用银氨溶液可以鉴别尼泊金甲酯和香兰素 |
(3)大茴香酸与香兰素互为同分异构体,它是一种羧酸,且具备以下3个特点。大茴香酸的结构简式为 。
a.分子中含有甲基
b.遇FeCl3溶液不显紫色
c.苯环上的一氯代物只有两种
(4)以丁香油酚为原料,通过下列路线合成香兰素。
(丁香油酚)
(注:分离方法和其他产物已经略去;乙酸酐的结构简式为 )
)
①由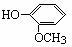 和ClCH2CH=CH2合成丁香油酚的反应类型属于 。
和ClCH2CH=CH2合成丁香油酚的反应类型属于 。
②步骤Ⅱ中,反应的化学方程式为 。
③W的结构简式为____________________。
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1mol•L‾1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O, 250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其△H= kJ·mol‾1。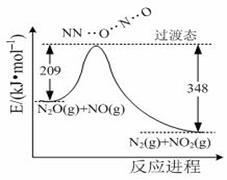
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为 。
(2)与OH-互为等电子体的一种分子为 (填化学式)。
(3)醛基中碳原子的轨道杂化类型是 ;1mol乙醛分子中含有的σ键的数目为 。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为 。
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为 。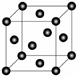
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)整个过程中的还原剂是 。
(3)把KI换成KBr,则CCl4层变为__色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用Kl与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。
(14分)氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)某课外学习小组欲制备少量NO气体,写出铁粉与足量稀硝酸反应制备NO的离子方程式: 。
(2)LiFePO4是一种新型动力锂电池的电极材料。
①下图为某LiFePO4电池充、放电时正极局部放大示意图,写出该电池放电时正极反应方程式: 。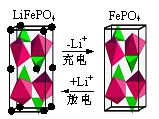
②将LiOH、FePO4·2H2O(米白色固体)与还原剂葡萄糖按一定计量数混合,在N2中高温焙烧可制得锂电池正极材料LiFePO4。焙烧过程中N2的作用是 ;实验室中以Fe3+为原料制得的FePO4·2H2O有时显红褐色,FePO4·2H2O中混有的杂质可能为 。
(3)磷及部分重要化合物的相互转化如图所示。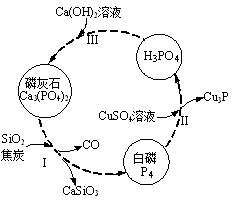
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1molCuSO4所能氧化的白磷的物质的量为 。
③步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有 。