(15分)“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH、HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:
CO2 (g)+3H2(g) CH3OH g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
CH3OH g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
| 容器 |
甲 |
乙 |
| 起始量 |
1molCO2(g)、3molH2(g) |
1molCH3OH(g)、1molH2O(g) |
| 平衡时c(CH3OH) |
C |
0.3mol/L |
| 平衡时能量变化 |
放出akJ |
吸收bkJ |
请回答:
①写出a、b的关系式:_______。
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是________。
(2)甲烷的一个重要用途是制取H2,其原理为:CO2 (g)+ CH4 (g)  2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则该反应的焓变△H 0(填“大于”、“小于”或“等于”),压强P1______P2(填“大于”或“小于”);压强为P2时,在y点:
2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则该反应的焓变△H 0(填“大于”、“小于”或“等于”),压强P1______P2(填“大于”或“小于”);压强为P2时,在y点: (正)_________
(正)_________ (逆)(填“大于”、“小于”或“等于”)。
(逆)(填“大于”、“小于”或“等于”)。

(3)一定条件下,治理汽车尾气的反应是 

 。在恒温恒压下的密闭容器中通入n(NO)/n(CO)=2:1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到
。在恒温恒压下的密闭容器中通入n(NO)/n(CO)=2:1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到 时刻一定达到平衡状态的是__________(选填字母)。
时刻一定达到平衡状态的是__________(选填字母)。

(4)甲酸(HCOOH)是一种弱酸,现用0.1mol·L-1 NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol·L-1叫的盐酸和甲酸溶液,滴定曲线如下:

上述图像中 为甲酸的滴定曲线,M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_________。
在密闭容器中,使2molN2和6molH2混合发生下列反应:
N2(g)+3H2(g)===2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是_______;N2和H2的转化率比是_________。
(2)升高平衡体系的温度(保持体积不变),混和气体的平均相对分子质量_______,密度________。(填“变大”、“变小”或“不变” )
(3)当达到平衡时,将C(N2)、C(H2)、C(NH3)同时减小一倍,平衡将向______移动。
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将向_________移动。
(5)若容器恒容,绝热、加热使容器内温度迅速升至原来的2倍,平衡将_______
(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度_______(填“大于”“小于”或“等于”)原来的2倍。
在一定条件下反应2SO2(g)+O2(g)===2SO3(g)达到平衡状态的标志是_______________________________。
①某物质含量不变②某物质转化率不变③某物质浓度不变④恒容压强不变⑤恒压体积不变⑥ v(正)= v(逆)⑦条件一定,平均相对分子质量不变⑧体积一定,气体密度不变
上述条件符合:H2(g)+ I2(g)===2HI(g)反应达平衡的有_____________;上述条件符合:A(g)+B(l)===C(g)反应达平衡的有_____________________。
密闭体系中发生下列反应:N2 + 3H2 ="===" 2NH3(正反应为放热反应),如图是某一时间段反应速率与反应进程的曲线关系图。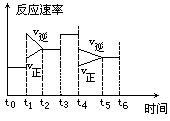
回答下列问题:
(1)处于平衡状态的时间段是_________________________________________________________
(2)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1:_______ t3:_______ t4:_________
(3)下列时间段中,氨的百分含量最高的是________
| A.t 0~t1、 | B.t2~t3 | C.t3~t4 | D.t5~t6 |
化学平衡移动原理同样也适用于其他平衡,已知在氨水中存在下列平衡:
NH3+H2O===NH3.H2O===NH4++OH-
(1)向氨水中加入MgCl2固体时,平衡向______________移动,OH-的浓度_______,
NH4+的浓度_______。
(2)向氨水中加入浓盐酸,此时溶液中浓度减小的微粒有_______、_______、_______。
(3)向浓氨水中加入少量的NaOH固体,平衡向_______移动,此时发生的现象是______________
______________。
对于溶液中进行的反应:FeCl3+3KSCN===Fe(SCN)3+3KCl,当其他条件一定时:
(1)向溶液中加入少量的KCl固体,溶液的颜色_______
(2)向溶液中加入少量KSCN固体,溶液的颜色_______
(3)加水稀释时,化学平衡向_______移动