以下合成路线是某化工厂生产流程的一部分:
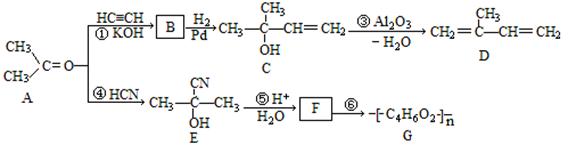
已知:①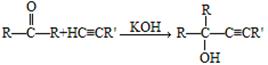
②
请回答下列问题:
(1)写出F中官能团的名称 。
(2)写出D的名称(系统命名) 。
(3)④的反应类型是 ;B的结构简式是 。
(4)写出反应⑥的化学方程式为 。
(5)H是D的同分异构体,核磁共振氢谱有3种峰且属于炔烃的结构简式为
、 。
(6)有关C的说法正确的是 。
| A.能使溴的四氯化碳溶液褪色 | B.能和氢氧化钠溶液反应 |
| C.能使酸性高锰酸钾褪色 | D.能与乙酸发生酯化反应 |
在T℃下,某Ba(OH)2稀溶液中c(H+)=10-a mol/L,c(OH—)=10-b mol/L,已知a+b=12,向该溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如下表所示:
| 序号 |
氢氧化钡溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
8 |
| ② |
22.00 |
18.00 |
7 |
| ③ |
22.00 |
22.00 |
6 |
(1)依据题意判断,T℃ 25℃(填“大于”、“小于”或“等于”),该温度下水的离子积KW=
(2)x= 原Ba(OH)2稀溶液的物质的浓度为
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2稀溶液时,沉淀正好达到最大值,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为 ,Na2SO4的物质的量浓度为
工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。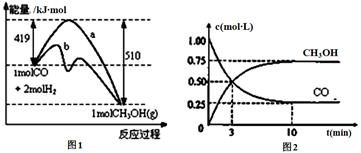
请回答下列问题:
(1)在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g) CH3OH(g)的△H= 。
CH3OH(g)的△H= 。
(2)下列说法正确的是
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,v(CO)= ;达到平衡时,c(H2)= ,该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数表达式为 。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡 移动 (填“正向”、“逆向”或“不”)。
CH3OH(g)的化学平衡常数表达式为 。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡 移动 (填“正向”、“逆向”或“不”)。
(4)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol, 又知H2O(l)= H2O(g);ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
工业制硫酸生产流程如下图:
催化室的反应为:2SO2+O2 2SO3△H<0
2SO3△H<0
(1)在沸腾炉中,需要将黄铁矿粉碎的目的是 。
(2)在催化反应室,下列措施中有利于提高SO2平衡转化率的有 。(填写编号)
a.减少压强 b.升高温度 c.不断补充空气 d.及时分离出SO3
(3)在450℃、常压和钒催化条件下,在容积为VL的恒容容器中加入2n molSO2和n molO2
判断反应达到平衡状态的标志是 。(填写编号)
a.SO2和SO3浓度相等b.SO2百分含量保持不变
c.容器中气体的压强不变d.SO3的生成速率与SO2的消耗速率相等
(4)图1、2表示该SO2和O2的反应在时刻t1达到平衡、在时刻t2因改变某个条件而发生变化的情况:
① 图1中时刻t2发生改变的条件是 。
② 图2中时刻t2发生改变的条件是 。
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5微米的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离 子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH= 。
(2)为减少SO2的排放,可洗涤含SO2的烟气,下列物质可作洗涤剂的是 (填字母)。
A. Ca(OH)2B. Na2CO3C. CaCl2D. NaHSO3
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g) 2NO(g) ΔH>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
2NO(g) ΔH>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g) 2C(s)+O2(g)。已知该反应的ΔH>0,简述该设想能否实现的依据 。
2C(s)+O2(g)。已知该反应的ΔH>0,简述该设想能否实现的依据 。
亚硝酸钠易溶于水,有碱味,有氧化性,也有还原性。NaNO2大量用于染料工业和有机合成工业中,也可用作水泥施工的抗冻剂。然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
______NaNO2 + _______KI + _______ _______NO +______I2 +______K2SO4 +______Na2SO4+_______
_______NO +______I2 +______K2SO4 +______Na2SO4+_______
(1)请完成该化学方程式并配平。
(2)在上述反应中,若要生成50.8 g I2,则电子转移了_______________个。
(3)现有25.00 mL的KI溶液,用酸化的10.00 mL 0.0500 mol/L的KIO3溶液处理(5I- + IO3- +6H+ = 3I2 + 3H2O)。将生成的I2全部除去后,再加入过量的KI溶液,使之与剩余的KIO3反应,然后将溶液调节至中性,析出的单质碘用0.1000 mol/L的Na2S2O3溶液滴定(2S2O32- + I2 = S4O62- + 2I-),用去该溶液的体积为21.00 mL。求剩余的KIO3为 mol,原KI溶液的物质的量浓度是 mol/L