某温度下,恒容密闭容器中,发生如下可逆反应:2 E(g) F(g) + x G(g)(正反应放热);若起始时E浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5amol/L,若E的起始浓度改为2amol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
F(g) + x G(g)(正反应放热);若起始时E浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5amol/L,若E的起始浓度改为2amol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
| A.升高温度时,正反应速率加快,逆反应速率减慢,平衡逆向移动 |
| B.若x=1,新平衡下E转化率为50% |
| C.若x=2,新平衡下F的平衡浓度为0.5a mol/L |
| D.若x=2,换成恒压容器,则达到平衡所需时间比恒容容器所需时间短 |
已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的的是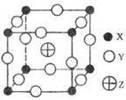
| A.ZXY3 |
| B.ZX2Y6 |
| C.ZX4Y8 |
| D.ZX8Y12 |
下列关于SiO2和金刚石的叙述正确的是
| A.SiO2晶体结构中,每个Si原子与2个O原子直接相连 |
| B.通常状况下,60 g SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) |
| C.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 |
| D.1 mol金刚石含4 NAC—C键 |
现有如下各种说法:①在水中氢、氧原子间均以化学键相结合 ②硅晶体熔化需要克服分子间作用力 ③离子键是阳离子和阴离子的相互吸引力 ④根据电离方程式HCl===H++Cl-,判断HCl分子里存在离子键⑤有化学键断裂的变化属于化学变化。上述各种说法正确的是
| A.都不正确 | B.① ② ⑤ | C.② ④ ⑤ | D.① ② ③ |
下面的排序不正确的是
| A.晶体熔点由低到高:CF4<CCl4 <CBr4 <CI4 |
| B.硬度由大到小:金刚石>碳化硅>晶体硅 |
| C.熔点由高到低:Na>Mg>Al |
| D.晶格能由大到小:NaF>NaCl>NaBr>NaI |
已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中,不正确的是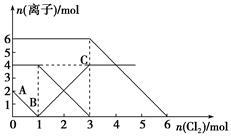
| A.还原性:I->Fe2+>Br- |
| B.原混合溶液中FeBr2的物质的量为6 mol |
| C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
| D.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |