下列有关电解质溶液说法正确的是
| A.向冰醋酸中逐滴加水稀释的过程中,溶液导电能力一直减小 |
| B.等浓度的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)] |
| C.等体积等浓度的CH3COONa、NaClO溶液中,前者离子总数小于后者 |
| D.等浓度的三种溶液中:①NH4HCO3、②NH4Cl、③NH4HSO4,c(NH4+)的大小顺序为:③>②>① |
反应2A(g) 2B(g)+E (g) △H>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
2B(g)+E (g) △H>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
| A.加压 | B.减压 | C.减小E的浓度 | D.降温 |
反应2SO2(g)+O2(g) 2SO3(g)经过一段时间后,SO3的浓度增加了0.4 mol•L-1,在这段时间内用O2表示的反应速率为0.04mol•(Ls)-1,则这段时间为
2SO3(g)经过一段时间后,SO3的浓度增加了0.4 mol•L-1,在这段时间内用O2表示的反应速率为0.04mol•(Ls)-1,则这段时间为
| A.5s | B.2.5s | C.0.1s | D.10s |
一定温度下,浓度均为1 mol•L-1的A2和B2两种气体,在密闭容器中反应生成气体C,反应达到平衡后,测得:c(A2)="0.58" mol•L-1,c(B2)="0.16" mol•L-1,c(C)=0.84mol•L-1,则该反应的正确表达式为:
A.2A2+B2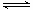 2A2B B.A2+B2
2A2B B.A2+B2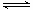 2AB
2AB
C.A2+B2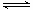 A2B2D.A2+2B2
A2B2D.A2+2B2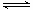 2AB2
2AB2
对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
| A.达到化学平衡时4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率的关系是2v逆(NH3)=3v正(H2O) |
10 mol浓度为1mol•L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气的生成的是
| A.NaHCO3 | B.CH3COONa | C.CuSO4 | D.Na2CO3 |