铁闸在海水中易被锈蚀,下图原理模型: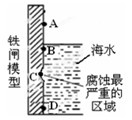
下列说法错误的是
| A.生成铁锈最多的是B点 |
| B.C处腐蚀时的电极反应为Fe-2e-=Fe2+ |
| C.以锌为负极,采用牺牲阳极法防止铁闸的腐蚀,可将锌放在C处。 |
| D.生锈最多的位置为腐蚀最严重的区域 |
下列反应既是离子反应,又是氧化还原反应的是
| A.氯化钠溶液中滴入硝酸银溶液 | B.铁片置于硫酸铜溶液中 |
| C.氢气在氯气中燃烧 | D.二氧化碳通入澄清石灰水中 |
溶液、胶体和浊液这三种分散系的根本区别是
| A.是否具有丁达尔现象 | B.分散质粒子直径的大小 |
| C.是否能透过滤纸 | D.是否为均一、稳定、透明的外观 |
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.标准状况下,22.4L H2含有的原子数为 NA |
| B.常温常压下,14g N2含有分子数为0.5NA |
| C.2.3g金属钠变为钠离子时失去的电子数为NA |
| D.物质的量浓度为0.5mol /L的MgCl2溶液中,含有Cl-个数为NA |
为了确定碳酸氢钠溶液中是否含有碳酸钠。下列实验操作及判断中正确的是
| A.观察加热时能否放出气体 |
| B.观察加盐酸时能否放出气体 |
| C.溶于水中,加入澄清石灰水,观察是否有白色沉淀生成 |
| D.溶于水中,滴加少量BaCl2溶液,观察是否有白色沉淀生成 |
某溶液中加入BaCl2溶液生成白色沉淀,再加入稀硝酸沉淀不溶解也无气体逸出,则这种溶液中
| A.一定含有SO42– | B.一定含有Ag+ |
| C.可能含有SO42– 或Ag+ 或CO32– | D.可能含有SO42– 或Ag+ |