实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:

(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。

(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。

①a为电源的 (填“正极”或“负极”),阳极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子反应方程式为: ,中氧化剂与还原剂的物质的量之比为 。
(选考)【化学——选修2:化学与技术】
在富碘卤水中,采用如图所示的工艺流程生产单质碘: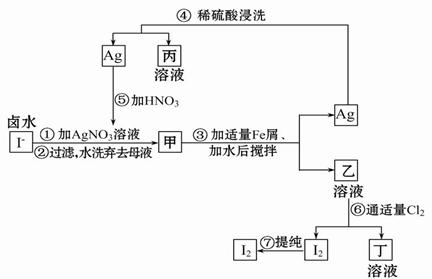
试回答:
(1)乙、丁中溶质的化学式:乙______________;丁____________。
(2)第④步操作中用稀硫酸浸洗的目的是____________(填写字母编号)。
A.除去未反应的AgI
B.除去未反应的I-
C.除去未反应的Fe
(3)第⑦步操作可供提纯I2的两种方法是______和______(不要求写具体步骤)。
(4)实验室检验I2的试剂是_______________。
(5)甲物质见光易变黑,其反应的化学方程_____________________。
(6)反应⑤中所加硝酸应选_________硝酸(填“浓”或“稀”),原因是____________________________。
(14分)二氯化二硫(S2C12)在工业上常用作橡胶硫化剂。实验室可用如下装置(略去夹持仪器)模拟生成过程。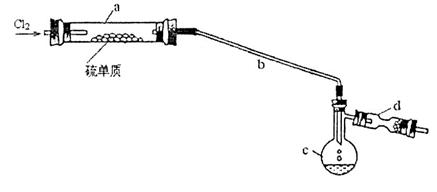
查阅资料:
①S2Cl2是一种金黄色易挥发液体(熔点:-76℃,沸点:138℃),具有强烈的窒息性,且易与水发生水解反应。
②将干燥的氯气在110℃~140℃与硫反应,即得到S2C12粗品。
(1)装置I、II、II连接可制取纯净、干燥的氯气,则两个II装置内的试剂依次是__________________。
制备C12的过程中,某实验小组利用刚吸收过少量SO2的NaOH溶液吸收C12,防止污染环境。吸收一段时间后,某同学取出2mL吸收后的溶液(强碱性)于试管中,充分振荡后向其中滴加3~4滴淀粉-KI溶液,发现溶液先变蓝,随即又褪去。溶液先变蓝,说明吸收Cl2后的溶液中存在__________(填微粒符号),蓝色褪去的可能原因是_____________________(用离子方程式回答)。
(2)长玻璃管b的作用是___________________。
(3)该实验的操作顺序应为______________________________ (用序号表示)。
| A.加热装置a | B.通入C12 |
| C.停止通Cl2 | D.停止加热装置a |
(4)装置d中应放置的试剂为______________________,其作用为__________________。
(4分)化学是一门以实验为基础的科学。
(1)下列与实验相关的叙述正确的是______________________(填写代号)。
A.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
B.“中和滴定”实验中,左手控制滴定管的玻璃活塞,右手旋摇锥形瓶,两眼注视滴定管内溶液液面变化,直至滴定终点
C.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
D.已知I3-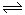 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CC14中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CC14中的溶解度比在水中的大
E.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用
(2)用仪器A、B和胶管组成装置收集NO气体(注:仪器A气密性良好;除水外不能选用其它试剂),正确的操作步骤是_________________________。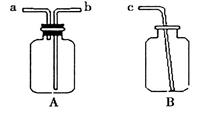
(13分)实验室为探究铁与浓硫酸的反应,并验证SO2的性质,设计如图所示装置进行实验。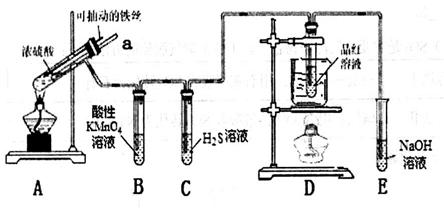
请回答下列问题:
(1)实验时A中导管a插入浓硫酸中,可使B中的溶液不发生倒吸。其原因是_______。
(2)B中酸性KMnO4逐渐褪色,则B中反应的离子方程式是_______________________;C中反应的化学方程式是_________________。
(3)D装置的作用是________;实验结束时需从a导管通入大量空气,其目的是___________。
(4)欲探究A装置中反应后铁元素的价态,设计实验方案如下:将反应后试管中的溶液稀释。取少许溶液,滴入3~5滴________溶液,若溶液呈红色,则证明含有Fe3+,否则不含Fe3+;取少许溶液,滴入3~5滴________溶液,若溶液褪色,则证明含有Fe2+,否则不含Fe2+。若实验证明反应后的溶液中只含有Fe3+,则A中反应的化学方程式是___________________________________________。
浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下: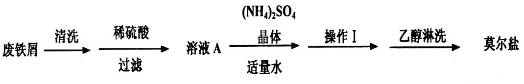
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是_________;
证明溶液A不含Fe3+离子的最佳试剂是_______________(填序号字母)。
a.酚酞溶液 b.KSCN溶液 c.烧碱溶液d.KMnO4溶液
操作I的步骤是:加热蒸发、___________、过滤。
(2)浓度均为0.1mol·L-1莫尔盐溶液和(NH4)2SO4溶液,c(NH4+)前者大于后者,原因是______。
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平_______(填“左”“右”)盘。
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a 接__________;__________接__________。
(5)将装置C中两种液体分离开的操作名称是_________。装置D的作用是_______________。