[化学—选修3:物质结构与性质]在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子。
(1)写出基态E原子的价电子排布式 。
(2)B、C、D三种元素第一电离能由小到大的顺序为 (用元素符号表示)。
(3)A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与化合物BD是等电子体,根据等电子体原理,写出化合物BD的电子式 。
(4)A2D的沸点在同族元素中最高,其原因是 。A2D由液态形成晶体时密度 (填“增大”、“不变”或“减小”),其主要原因 (用文字叙述)。
(5)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为 (用元素符号表示);若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g·cm-3(用含a、NA的符号表示)。

(7分)(1)用系统命名法给下列物质命名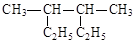 名称:
名称: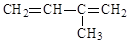 名称:
名称:
(2)分子式为C5H10的烯烃的结构有种,其中有三个—CH3的结构简式为:。 一氯丁烯的同分异构体有8种,分子里含有
一氯丁烯的同分异构体有8种,分子里含有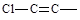 结构的有种
结构的有种
在恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g) C(g)+D(g),所得实验数据如下表:
C(g)+D(g),所得实验数据如下表:
| 实验 编号 |
温度/℃ |
起始时物质的量/mol |
平衡时物质的量/mol |
||
| n(A) |
n(B) |
n(D) |
|||
| ① |
700 |
0.40 |
0.10 |
0.090 |
|
| ② |
800 |
0.10 |
0.40 |
0.080 |
|
| ③ |
800 |
0.20 |
0.30 |
a |
|
| ④ |
900 |
0.10 |
0.15 |
b |
请回答下列问题
(1)表中 2(选填“>”、“=”或“<”)
2(选填“>”、“=”或“<”)
(2)800℃时,若起始时向该容器中充入0.5molA(g)、1.0molB(g)、0.3molC(g)、1.8molD(g),则反应开始时的反应速率 v (正)v (逆) (选填“>”、“=”或“<”)。
(3)实验③中,达到平衡时X的转化率为多少?(写出解题过程)
(8分)孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:
请回答下列问题:
(1)研磨孔雀石的目的是。
(2)加入双氧水的目的是将溶液中的Fe2+转化为Fe3+,相应的离子方程式为。
(3)固体c中主要成分的化学式为。加入氧化铜的作用是。
A、B、C、D分别是(NH4)2SO4、Ba(OH)2、AlCl3、Na2CO3四种物质中的某一种,现进行如下实验:
①实验测得A溶液和D溶液显碱性,B溶液和C溶液显酸性;
②A溶液和D溶液混合可生成沉淀甲
③足量A溶液与B溶液混合共热可生成沉淀乙和刺激性气味气体;
请回答下列问题:
(1)A的化学式为________,D的化学式为________。
(2)将C溶液加热蒸干,并灼烧至恒重,最后所得固体为________(填化学式)。
(3)B溶液中离子浓度由大到小的顺序为。
(4)将沉淀甲加入到B溶液中,沉淀甲会转化为沉淀乙。沉淀甲能转化为沉淀乙的原因是。沉淀甲转化为沉淀乙的离子方程式是。
对于反应:CO(g)+H2O(g)  CO2(g)+H2 (g)ΔH>0请回答下列问题:
CO2(g)+H2 (g)ΔH>0请回答下列问题:
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如图,则 0~4min内的平均反应速率v(CO)=______ mol/(L·min)
(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
则:
①C1数值___(选填“>”、“<”或“=”)0.08 mol/L。
②反应在4min~5min间,平衡向逆反应方向移动,可能的原因是________(单选);表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂d.增加氢气浓度