短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,常见金属元素Z的一种核素的质量数为28,中子数比质子数多2。下列说法中正确的是
| A.用“百度”搜索知,Y、Z形成的化合物“室温下强度高,……。导热性好,热膨胀系数小,是良好的耐热冲击材料。”由此可推测该化合物属于离子晶体 |
| B.化合物YW3水解产物之一具有强氧化性,由此可知Y在该化合物中的化合价为+3 |
| C.由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液 |
| D.因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z |
【2015北京理综化学】下列关于自然界中氮循环(如图)的说法不正确的是
| A.氮元素均被氧化 |
| B.工业合成氨属于人工固氮 |
| C.含氮无机物和含氮有机物可相互转化 |
| D.碳、氢、氧三种元素也参与了氮循环 |
【2015福建理综化学】纯净物X、Y、Z转化关系如图所示,下列判断正确的是
| A.X可能是金属铜 |
| B.Y不可能是氢气 |
| C.Z可能是氯化钠 |
| D.Z可能是三氧化硫 |
【2015重庆理综化学】下列说法正确的是
| A.I的原子半径大于Br,HI比HBr的热稳定性强 |
| B.P的非金属性强于Si,H3PO4比H2SiO3的酸性强 |
| C.Al2O3和MgO均可与NaOH溶液反应 |
| D.SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |
【2015新课标Ⅱ卷理综化学】海水开发利用的部分过程如图所示。下列说法错误的是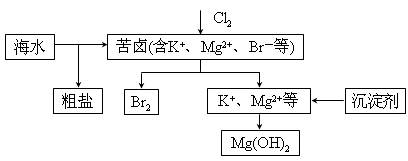
| A.向苦卤中通入Cl2是为了提取溴 |
| B.粗盐可采用除杂和重结晶等过程提纯 |
| C.工业生产中常选用NaOH作为沉淀剂 |
| D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
【2015新课标Ⅱ卷理综化学】食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是
| A.硅胶可用作食品干燥剂 |
| B.P2O5不可用作食品干燥剂 |
| C.六水合氯化钙可用作食品干燥剂 |
| D.加工后具有吸水性的植物纤维可用作食品干燥剂 |