由几种常见的盐混合组成的白色粉末,其中只可能含有Na+、K+、Al3+、CO32-、HCO3-、SO42-、NO2-中的若干种离子。某同学对该溶液进行如下实验:
以下说法正确的是
| A.白色沉淀甲是Al(OH)3,气体甲是CO2,所以混合物一定含Al3+和HCO3- |
| B.气体乙一定是NO和NO2的混合气体 |
| C.白色沉淀乙是BaSO4,所以原混合物一定含有SO42- |
| D.白色粉末中一定含有Na+、Al3+ 、NO2- |
常温下,1.0mol/L一元酸HA与等体积等浓度KOH溶液混合,所得溶液粒子的浓度关系如右表(不含水分子的5种粒子,A为短周期元素),下列说法正确的是
| 粒子 |
K+ |
A- |
X |
Y |
Z |
| 浓度(mol/L) |
0.50 |
0.49 |
c(X)>c(Y)>c(Z) |
A.元素A最高价氧化物对应水化物为HAO4
B.表格中X表示HA,Y表示H+
C.所得溶液中c(X)+ c(A-)= c(K+)
D.等体积等浓度的HA和盐酸分别加水稀释10倍后,pH (HA) >pH(HCl)
如图甲池和乙池中的四个电极都是惰性材料,请根据图示判断下列说法正确的是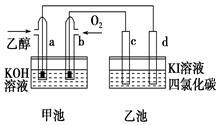
| A.两个装置之间没有盐桥,故不能形成电流 |
| B.a电极的电极反应式 C2H5OH+16OH--12e-==2CO32-+11H2O |
| C.一段时间后,乙池d电极周围的溶液呈现棕褐色 |
| D.乙池在反应前后溶液的pH不变 |
分子式为C5H10O2 ,即能和金属钠反应,又能发生银镜反应的有机化合物有多少种(不考虑立体异构)
| A.10 | B.11 | C.12 | D.13 |
下列各组离子能在溶液中大量共存的是
| A.K+、Na+、Cl-、NO3- | B.Fe3+、K+、Br-、SCN- |
| C.NH4+、Na+、CO32-、OH- | D.Al3+、Mg2+、SO42-、HCO3- |
下列说法正确的是
| A.滴定管和锥形瓶在使用前要用润洗 |
| B.检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 |
| D.将CO2和SO2混合气体分别通入BaC12溶液、Ba(NO3)2溶液中,最终都有沉淀生成 |