(15分)Ⅰ.施莱辛(Schlesinger)等人提出可用NaBH4与水反应制取氢气:BH4- + 2H2O ="=" BO2- + 4H2↑(反应实质为水电离出来的H+被还原)。研究表明,该反应生成H2的速率受外界条件影响,下表为pH和温度对NaBH4半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间)。
| 体系 pH |
不同温度下的半衰期(min) |
|||
| 0℃ |
25℃ |
50℃ |
75℃ |
|
| 8 |
4.32×100 |
6.19×10-1 |
8.64×10-2 |
1.22×10-2 |
| 10 |
4.32×102 |
6.19×101 |
8.64×100 |
1.22×100 |
| 12 |
4.32×104 |
6.19×103 |
8.64×102 |
1.22×102 |
| 14 |
4.32×106 |
6.19×105 |
8.64×104 |
1.22×104 |
(1)已知NaBH4与水反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因 ,溶液中各离子浓度大小关系为 。
(2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响? 。
(3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响? 。
Ⅱ.肼(N2H4)又称联氨,常温下是一种无色油状液体,沸点为113.5℃。肼和氧气在不同温度和催化剂条件下生成不同产物(如图)。
温度较低时主要反应①:N2H4 + O2  N2 + 2H2O
N2 + 2H2O
温度较高时主要反应②:N2H4 + 2O2 2NO + 2H2O
2NO + 2H2O
不考虑其他反应,完成下列填空:
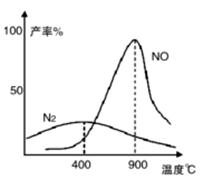
(4)若反应①在250℃时的平衡常数为K1,350℃时的平常数为K2,
则K1 K2(填“>”、“<”或“=”)。
(5)反应于1100℃时达到平衡后,下列措施能使容器中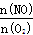 增大的有 (填字母序号)。
增大的有 (填字母序号)。
A.恒容条件下,充入He气 B.增大容器体积
C.恒容条件下,充入N2H4 D.使用催化剂
(6)若将n mol肼和2n molO2充入某容积为n L的刚性容器中,在800℃和一定压强、合适催化剂的作用下,反应①和②同时达到平衡,实验测得N2的产率x,NO的产率为y,则该条件下反应②的平衡常数K= (用x、y的代数式表示,不必化简)。
已知几种离子的还原能力强弱顺序为I—>Fe2+>Br—,现有200mL混合溶液中含FeI2、FeBr2各0.10mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其它反应)。
(1)若氯水中有0.15 mol Cl2被还原,则所得溶液中含有的阴离子主要是,剩余Fe2+的物质的量为。
(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为,若最终所得溶液为400mL,其中主要阳离子及其物质的量浓度为。
(3)通过对上述反应的分析,试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是。
(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸)。试写出此反应的离子方程式,上述所有反应共消耗Cl2mol。
在某无色溶液里,只含有下列8种离子中的某几种:Na+、H+、Ag+、Mg2+、Cl-、OH-、HCO3—、NO3—。已知该溶液能跟铝粉反应,且放出的气体只有H2。试回答:
(1)若溶液和铝粉反应后有AlO2-生成,则溶液中一定含有大量的_____________离子,还可能含有大量的________离子。
(2)若溶液和铝粉反应后有Al3+生成则溶液中一定含有大量的________离子,原溶液中一定不含有大量的________离子。
无机化合物可根据其组成和性质进行分类,以下是一组对“一些物质与水反应”的分类图,请按要求填空.
(1)上述分类中,分成A、B两组的依据是.
(2)C组物质与水反应的离子方程式为.
(3)D组物质与水反应中,氧化剂和还原剂物质的量之比为1:1的物质有(填化学式).
下图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题: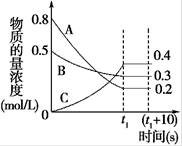
(1)该反应的化学方程式为。
(2)0~t1s 内B气体的平均反应速率为。
(3)(t1+10)s 时,A的转化率为,此时v(A)正v(B)逆(填“>”、“<”或“=”)。
(4)关于该反应的说法正确的是。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为。
C、N、O、Al、Si、Cl、Fe是七种常见元素
(1)N元素位于周期表第周期,第族,C元素的一种同位素可测定文物年代,这种同位素的符号是。
(2)用“>”、“<”或“= ”填空:
| 离子半径 |
得电子能力 |
酸性 |
金属性 |
| O2―Al3+ |
16O18O |
H2CO3HNO3 |
FeAl |
(3)SiO2及硅酸盐在自然界广泛存在,在日常生活、生产、科研及新型材料等方面有着重要的用途。高岭土[Al2(Si2O5)(OH)4]改写成氧化物的形式为。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目。
(5)将铝片(表面除去氧化膜)与碳棒用导线连接后插入稀NaOH溶液中可以构成原电池,电池正极为,电池负极反应的电极方程式为。