现有1.0 mol/L的NaOH溶液0.2L,若通入4.48L(标准状况)SO2气体使其充分反应后,则所得溶液中各粒子浓度大小关系正确的是
| A.c(Na+) = c(H2SO3) + c(HSO3―) + c ( H+) |
| B.c(SO32―) + c( OH―) = c(H+) + c(H2SO3) |
| C.c(Na+)+c(H+) = c(HSO3―) +c(SO32―) + c( OH―) |
| D.c(Na+)>c(HSO3―)>c( OH―)>c(H2SO3)>c(SO32―)>c(H+) |
下列电池工作时能量转化形式与其它三个不同的是
某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3(2三种杂质中的一种或两种,现将6.9 g样品溶于足量水中,得到澄清溶液,若再加入过量的CaCl2溶液,得到4.5g沉淀,对样品所含杂质的正确判断是
| A.肯定有KNO3和Na2CO3,没有Ba(NO3(2 |
| B.肯定有KNO3,没有Ba(NO3(2,可能还有Na2CO3 |
| C.肯定没有Na2CO3和Ba(NO3(2,可能有KNO3 |
| D.以上判断都不正确 |
常温下,在下列溶液中发生如下反应:
①16H++10Z-+2XO4-=2X2++5Z2+8H2O
②2A2++B2===2A3++2B-③2B-+Z2===B2+2Z-由此判断下列说法正确的是
| A.反应Z2+2A2+===2A3++2Z-不能进行 |
| B.Z元素在①③反应中均被氧化 |
| C.氧化性由弱到强的顺序是XO、Z2、B2、A3+ |
| D.还原性由强到弱的顺序是A2+、B-、Z-、X2+ |
下列说法正确的是
①氯气的性质活泼,它与氢气混合后立即发生爆炸 ②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收 ③久置氯水的酸性强于新制氯水 ④检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液 ⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水中
| A.①②③ |
| B.②③④ |
| C.③ |
| D.③⑤ |
在a L Al2(SO4(3和(NH4(2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中Al3+的浓度(mol·L-1)为
A.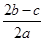 |
B.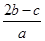 |
C.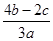 |
D. |