【原创】NA表示阿伏加德罗常数,下列叙述中正确的是
| A.18g的H218O中含有的中子数为10NA |
| B.标准状况下,6.0g乙酸分子中含有C—H共价键的数目为0.3NA |
| C.1molFe与氯气反应,一定转移3NA个电子 |
| D.同温同压同体积的CO2和SO2所含氧原子数均为2NA |
将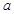 mol金属铜和含有
mol金属铜和含有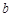 mol硝酸的溶液恰好完全反应,则反应中起酸性作用的硝酸的物质的量为( )
mol硝酸的溶液恰好完全反应,则反应中起酸性作用的硝酸的物质的量为( )
A.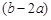 mol mol |
B.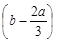 mol mol |
C.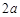 mol mol |
D.缺条件,无法计算 |
以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2mol Fe(OH)3沉淀。此过程中共消耗水( )
| A.3mol | B.4mol | C.5mol | D.6mol |
肼(N2H4)一空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%-30%的KOH溶液。电池总反应为:N2H4+O2=N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是( )
| A.溶液中阴离子物质的量基本不变 |
| B.正极的电极反应式是:O2+4H++4e―=2H2O |
| C.正极的电极反应式是:N2H4+4OH--4e=4H2O+N2↑ |
| D.溶液中阴离子向正极移动 |
下列说法正确的是( )
| A.在101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ热量,H2的燃烧热为 -285.8kJ·mol-1 |
| B.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 |
| C.在101k Pa时,1mol C与适量O2反应生成1mol CO时,放出110.5kJ热量,则C的燃烧热为110.5kJ·mol-1 |
D.在稀溶液中,H+(aq)+OH-(aq)=H2O(l),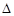 H=-57.31 kJ·mol-1。若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ H=-57.31 kJ·mol-1。若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的某几种,现取该溶液进行实验得到如下现象:①向溶液中滴加适量氯水后,溶液变橙色,且有无色气泡冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀产生;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断,该溶液中肯定不存在的离子组是( )
| A.Al3+、Mg2+、I-、SO32- | B.Mg2+、Na+、CO32-、I- |
| C.Al3+、Na+、SO32-、I- | D.Al3+、CO32-、Br-、SO32- |