【改编】氨的合成是最重要的化工生产之一。
I.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+ H2O(g) CO(g)+ H2(g);
CO(g)+ H2(g);
②用天然气跟水蒸气反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
已知有关反应的能量变化如下图,则方法②中反应的ΔH=_____________。
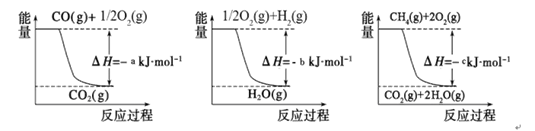
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+ N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
| 达到平衡的时间(min) |
t |
5 |
8 |
| 平衡时N2的浓度(mol·L-1) |
c1 |
3 |
|
| N2的体积分数 |
ω1 |
ω2 |
ω3 |
| 混合气体密度(g·L-1) |
ρ1 |
ρ2 |
|
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min (填>、<或=)
(3)乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4)分析上表数据,下列关系正确的是________。
a.2c1=3mol/L b.ω1=ω2 c.2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=____ __(用分数表示)(mol/L)-2。
金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融) 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是 。
A.放在棕色瓶中 B.放在细沙中
C.放在水中 D.放在煤油中
(2)钠长时间放在空气中,最后的产物主要成分是 。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
(3)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式 ,生成物的颜色为 。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的化学方程式为 ,检验该反应产生的气体的方法是 。
某银白色金属固体A:①放在空气中氧化成白色固体B;②将A点燃火焰呈黄色,生成浅黄色固体C;③A、B、C均可跟无色液体D反应,生成碱性物质E,其中A跟D反应时还可生成可燃性气体F,C跟D反应时则生成另一种气体G;④F和G混合遇火可剧烈反应而发生爆炸,并生成D。
据此推断:
(1)C为 ,D为 ,F为 。
(2)写出下列反应的化学方程式:
①A→B: ;
②C→E: 。
某反应体系中的物质有NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内并配平(教材变化,要求配平):
Au2O3+ + → + +
(2)反应中,被还原的元素是 ,还原剂是 。
(3)当有1 mol氧化剂参加反应时,得到氧化产物的物质的量是 mol,电子转移数目是 。
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂的物质的量之比为 。
)已知砒霜As2O3与Zn可以发生如下反应:
As2O3+6Zn+6H2SO4====2AsH3+6ZnSO4+3H2O
(1)请用双线桥法标出电子转移的方向和数目:
。
(2)As2O3在上述反应中显示的性质是 。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(3)该反应的氧化产物是 ,还原产物是 。
(4)若生成0.1 mol AsH3,则转移的电子数为 。
已知:氮元素有-3、0、+1、+2、+3、+4和+5七种化合价,试据此判断下列六种化合物:①NO ②N2O3 ③N2O4 ④HNO3 ⑤NH3 ⑥N2O中:
(1)氮元素只能作还原剂的是 (填序号,下同)。
(2)可能是HNO2还原产物的是 。
(3)不可能是N2的氧化产物的是 。
(4)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式
。