软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下: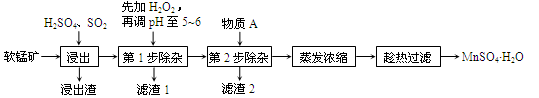
已知:Fe3+、Al3+、Mn2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、10.4、12.4;温度高于27℃时,MnSO4的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为________。
(2)“浸出”过程中Fe2O3转化为Fe3+和Fe2+,相关反应的离子方程式为________。
(3)“滤渣1”的主要成分是__________,“调pH至5~6”所加的试剂是_________(填“石灰水”或“稀硫酸”)。
(4)根据下表数据,选择“第2步除杂”所加的物质A(由一种阳离子和一种阴离子组成),物质A的化学式为________。
 阴离子 阴离子Ksp  阳离子 |
CO32- |
F- |
OH- |
| Ca2+ |
5.0×10-9 |
1.5×10-10 |
4.7×10-6 |
| Mg2+ |
3.8×10-6 |
7.4×10-11 |
5.6×10-12 |
| Mn2+ |
2.2×10-11 |
5.3×10-3 |
2.1×10-13 |
| Zn2+ |
1.2×10-10 |
3.0×10-2 |
6.9×10-17 |
(5)采用“趁热过滤”操作的原因是________。
工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI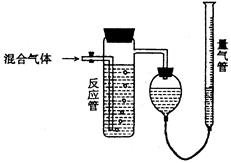
(1)混合气体进入反应管后,量气管内增加的水的体积等于的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量(选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用代替(填写物质名称)。
(4若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C.Va.Vb表示SO2的体积百分含量为:。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为.(选下列仪器的编号)。
a.烧杯
b.试管
c.广口瓶
d.容量瓶
e.量筒
f.单孔塞
g.双孔塞
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
(2)饱和碳酸钠溶液的主要作用是。
| A.中和乙酸 | B.吸收乙醇 |
| C.降低酯的溶解度使分层清晰 | D.有利于酯的水解 |
(3)若要把制得的乙酸乙酯分离出来,应采用的实验操作是。
(4)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有。(填序号)
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
某小组同学要配制100 mL 0.100 mol·L-1 Na2CO3溶液。下图是一些关键步骤和操作。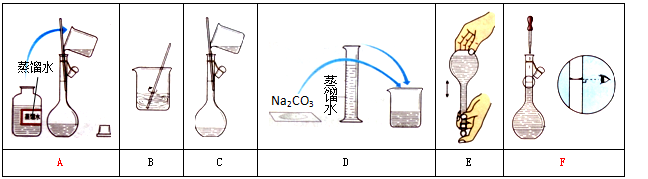
(1)配制过程的先后顺序为(用字母A~F填写)。
(2)配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、。
(3)若用Na2CO3·10H2O晶体来配制溶液,需要称量固体,但晶体已经部分失去结晶水,则所配得溶液的浓度会(填“偏高”、“偏低”、“不变”)。
(4)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将(填“偏高”、“偏低”、“不变”);步骤F称为,如果俯视刻度线,配得溶液的浓度将(填“偏高”、“偏低”、“不变”)。
(5)在步骤B之后,需才进行下一步操作。
下图为苯和溴的取代反应的改进实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入铁屑少量。填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出试管A中所发生反应的化学方程式(有机物写结构简式)______________ _______;
(2)试管C中苯的作用为________________________________________;
(3)反应2至3min后,在盛NaOH溶液的B中可观察到的现象为_________________________;
(4)在上述整套装置中,具有防倒吸作用的仪器有_____________ _______(填字母);
(5)能说明苯与溴发生的是取代反应而不是加成反应的现象为________ _________________。
(6分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室用教材的装置制取乙酸乙酯。回答下列问题:
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:。
(2)浓硫酸的作用是:①;②。
(3)饱和碳酸钠溶液的主要作用是。