【改编】E~N等元素在周期表中的相对位置如下表。E与K的原子序数相差5,K是地壳中含量最多的元素,下列判断不正确的是
| E |
|
|
|
K |
| F |
G |
|
M |
L |
| |
H |
|
N |
|
A.E与K化合可以生成两种化合物
B.氢化物的稳定性和沸点:K>L>M
C.H与N的原子核外电子数相差3
D.最高价氧化物的水化物碱性:F>G
已知:(NH4)2CO3(s)====NH4HCO3(s)+NH3(g) ΔH="+74.9" kJ·mol-1,下列说法中正确的是( )
| A.该反应中熵变小于0,焓变大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.判断反应能否自发进行需要根据ΔH与ΔS综合考虑 |
下列说法中不正确的是( )
| A.对于任何化学反应来说,反应速率越大,反应现象就越明显 |
| B.在其他条件不变时,升高温度一定会加快化学反应的反应速率 |
| C.使用合理的催化剂,可以改变化学反应速率,但不能改变化学平衡状态 |
| D.增大反应物浓度,可使单位体积内活化分子数增加,反应速率加快 |
下列实验事实不能证明醋酸是弱酸的是( )
| A.常温下,测得醋酸钠溶液的pH>7 |
| B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4 |
| C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4 |
| D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和 |
将0.05  的醋酸溶液加水稀释时,下列说法正确的是( )
的醋酸溶液加水稀释时,下列说法正确的是( )
| A.溶液中氢氧根离子的浓度增大了 |
B.c 减小,电离平衡向生成醋酸分子的方向移动 减小,电离平衡向生成醋酸分子的方向移动 |
| C.平衡向电离的方向移动,氢离子的浓度增大,醋酸分子的数量减少 |
D.电离程度增大,c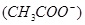 也增大了 也增大了 |
下列关于FeCl3水解的说法错误的是 ( )
| A.水解达到平衡时(不饱和),加氯化铁达饱和溶液,溶液的酸性会增强 |
| B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小 |
| C.有50℃和20℃的同浓度的两种FeCl3稀溶液,其他条件相同时,Fe3+的水解程度前者比后者小 |
| D.为抑制Fe3+的水解,较好地保存FeCl3溶液,应加少量盐酸 |