【改编】下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
陈述I |
陈述Ⅱ |
| A |
KSCN溶液也可检验Fe2+ |
待测液先后滴入足量氯水和几滴KSCN溶液后变为血红色,证明待测液含Fe2+ |
| B |
SO2具有漂白性 |
SO2通入溴水中溴水褪色 |
| C |
NaHCO3为强碱弱酸盐 |
NaHCO3溶液显碱性 |
| D |
反应物比例不同可导致产物不同 |
铁与氯气化合可能生成氯化铁,也可能生成氯化亚铁 |
已知重铬酸钾(K2Cr2O7)是一种比高锰酸钾还要强的氧化剂,其溶液中存在如下平衡:
2CrO42—(黄色)+2H + Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
若要使溶液的橙色加深,下列可采用的方法是
| A.加入适量稀盐酸 | B.加入适量稀硫酸 |
| C.加入适量烧碱固体 | D.加水稀释 |
已知:
①CH4 ( g )+4NO2( g )=4NO( g ) +CO2( g )+2H2O( g )△H=一574 kJ·mol-1
②CH4 ( g )+4NO( g )=2N2( g )+CO2( g )+2H2O( g )△H=一1160 kJ·mol一1
下列正确的选项是
A.CH4 ( g )+2NO2 ( g )= N2( g )+C O2 ( g )+2H2O ( l)△H=一867 kJ·mol-1 O2 ( g )+2H2O ( l)△H=一867 kJ·mol-1 |
| B.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O ( g)△H=一867 kJ·mol-1 |
C.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O ( g)△H=一586kJ·mol -1 -1 |
| D.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O ( g)△H=+586kJ·mol-1 |
如图表示中和滴定时某同学的一个操作,下列叙述正确的是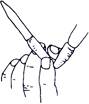
| A.这是一个错误操作 |
| B.该操作是为了排除滴定管内气泡 |
| C.该操作是为了防止滴定管漏液 |
| D.该操作是为了调节滴定管内液体的液面高低 |
将纯水加热至较高温度,下列叙述正确的是
| A.水的离子积变大、pH变小、呈酸性 |
| B.水的离子积不变,pH不变、呈中性 |
| C.水的离子积变小、pH变大、呈碱性 |
| D.水的离子积变大、pH变小、呈中性 |
在2A+B=3C+4D反应中,表示该反应速率最快的数据是
| A.υA= 0.5mol·L-1·s-1 | B.υB= 0.3mol·L-1·s-1 |
| C.υC= 0.8mol·L-1·s-1 | D.υD= 1.0mol·L-1·s-1 |