【改编】25℃时,0.1mol/LNa2CO3溶液pH=12,下列判断正确的是
A.通入少量HCl气体后溶液中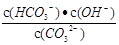 增大 增大 |
| B.升高温度溶液中c(OH-)和c(CO32-)均增大 |
| C.2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| D.c(HCO3-)+c(H+)+2c(H2CO3)=0.01mol/L |
化学来源于生活,并应用于生产生活中。下列关于化学与生产、生活的认识不正确的是
| A.将煤气化、液化等方法处理,是提高燃料燃烧效率的重要措施之一 |
| B.CO2、CH4、N2等均是造成温室效应的气体 |
| C.甲醇、天然气、液化石油气、氢气都可以作为燃料电池的原料,其中氢气是最为环保的原料 |
| D.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
常温常压下,乙烷、乙炔和丙烯组成的混合烃64mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了112 mL,原混合烃中乙炔的体积分数为( )
| A.12.5% | B.25% | C.50% | D.75。 |
一定条件下存在反应:2SO2(g)+O2(g) 2SO3(g),△H=-QkJ·mol-1。现有三个体积固定的容器I、II、III,体积分别为1L、1L和2L,其中I、II为绝热容器,III为恒温容器,各容器中充入的物质的量(mol)如下表:
2SO3(g),△H=-QkJ·mol-1。现有三个体积固定的容器I、II、III,体积分别为1L、1L和2L,其中I、II为绝热容器,III为恒温容器,各容器中充入的物质的量(mol)如下表:
| SO2 |
O2 |
2SO3 |
|
| I |
2 |
1 |
0 |
| II |
0 |
0 |
2 |
| III |
2 |
1 |
2 |
下列说法正确的是
A.容器I、II中产生的总热量(只考虑热值,不考虑符号)小于Q
B.容器I、III中反应的平衡常数相同
C.按起始加入的各物质的量将容器I与容器II无缝对接后,达到平衡后,各物质的量浓度与容器III平衡时浓度相同
D.平衡后,SO2的正反应速率大小关系:I>III>II
有人曾建议用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg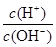 。室温下实验室中用0.01mol/L的氢氧化钠溶液滴定相同浓度的体积为20mL醋酸,滴定曲线如图所示。
。室温下实验室中用0.01mol/L的氢氧化钠溶液滴定相同浓度的体积为20mL醋酸,滴定曲线如图所示。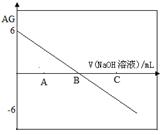
下列有关叙述正确的是
| A.B点时加入氢氧化钠溶液体积为20mL |
| B.室温时0.01mol/L的醋酸电离度为1% |
| C.A点时溶液中一定有c(CH3COO—)>c(CH3COOH) |
| D.若C点时加入氢氧化钠溶液40 mL,所得溶液中:c(CH3COO—)+ 2c(CH3COOH) =c(OH—)-c(H+) |
下列实验或方案正确的是
| A.在漂白粉中滴入70%的硫酸,立即产生黄绿色气体,说明硫酸具有还原性 |
| B.用一束强光照射Na2SiO3溶液,溶液中出现光亮通路,溶液中可能有硅酸胶体 |
| C.向溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀,溶液中一定含有SO42— |
| D.检验蔗糖水解产物具有还原性:在蔗糖水解后的溶液中先加入适量稀NaOH溶液中和,再加入新制的银氨溶液并水浴加热 |