电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水一般采用氧化法,常用的氧化剂有氯气、二氧化氯、次氯酸盐双氧水等。
(1)工业上常用双氧水处理含CN-离子浓度较低的废水,流程如下:
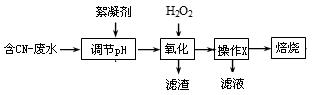
操作X的名称为 。滤液中常含有H2O2,排放前需除去,写出除去H2O2的方法
(2)实验室中可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
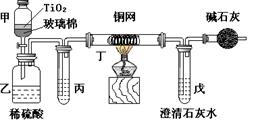
①乙中反应的离子方程式为 。丁在实验中的作用是 。
②乙中生成的气体除N2和CO2外,还有副产物HCl及Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是 (填字母)
| A.饱和食盐水 | B.饱和NaHCO3溶液 |
| C.浓NaOH溶液 | D.浓硫酸 |
③若该测得值与实际处理的百分率相比偏低,请简要说明可能的原因 。请提出一个能提高准确度的建议(具体操作) 。
④处理后的溶液,主要含有HClO、Na+、H+、Cl-等,请设计实验证明溶液中含有HClO和H+的实验方案:
文献资料显示,草木灰主要含有不溶性杂质及K2CO3,还含有少量KCl、K2SO4等。某化学兴趣小组拟测定草木灰中钾盐的含量及钾盐中K2CO3的含量。
测定草木灰中钾盐含量
(1)该实验的主要步骤顺序为:称量→→→→ →冷却→再称量(填字母序号)
A. 溶解 B.过滤 C、洗涤、烘干 D、蒸发
(2)称量前,在调整托盘天平的零点时,若指针偏向右边,应将右边的螺丝向(填左、右)旋动。某学生称量时,在天平右盘加上规定质量的砝码后,在左盘的小烧杯中加入样品,此时指针稍偏右边,该学生的操作应为。
(3)实验中A、B、C、D三步操作均使用了玻璃棒,操作B中玻璃棒的作用是,操作D用玻璃棒不断搅动的原因。
测定钾盐中K2CO3含量
(4)取上述操作中所得的钾盐,配成稀溶液,加入CaCl2溶液使CO32-生成沉淀,过滤得到碳酸钙沉淀后,用蒸馏水多次洗涤,烘干、称量、计算。检验沉淀是否完全的方法是,检验沉淀是否洗净的方法是。
某校化学小组学生利用“废铁屑与水反应”的产物还原氧化铜,并制取FeCl3·6H2O晶体。(图中夹持、加热及尾气处理装置均已略去)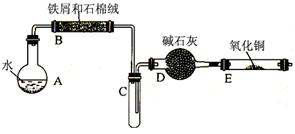
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用蒸馏水洗涤2~3遍,用滤纸吸干水分。
②将洗涤干燥后的废铁屑和石棉绒混合置于气密性良好的上述装置B中。
③先点燃X处的酒精灯,待试管C中出现大量水雾时,点燃Y处的酒精喷灯。
④经过必要的实验操作后,点燃Z处的酒精灯。
⑤停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。
⑥利用上述滤液制取FeCl3·6H2O晶体,设计流程如下: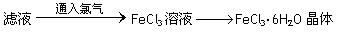
回答下列问题:
(1)实验步骤①的目的是。
(2)步骤③X处是指(用图中的A、B、C……表示),待试管C中出现大量水雾时,点燃Y处的酒精喷灯的目的是:。
(3)步骤④必要的实验操作是指:。
(4)步骤⑥从FeCl3溶液中得到FeCl3·6H2O晶体的主要操作包括:
。
(5)这个流程中需保持盐酸过量,主要原因是:
。
某校研究性学习小组设计了如图所示装置进行有关实验,实验时将分液漏斗中A逐滴加入烧瓶B中,(图中铁架台、铁夹已略去,要求填写的试剂的均填化学式)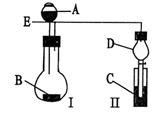
(1)若A为浓硫酸,B为第三周期金属元素的单质,
其在常温下难与水反应;C为品红溶液,实验
观察到C中溶液褪色,则B是,简述判断B的理由,
若使C试管溶液恢复原来的颜色,可采取的操作为。
(2)若B为块状大理石,C为饱和Na2CO3溶液,实验中观察到小试管内溶液变浑浊,则C试管中发生反应的化学方程式为。
(3)若B是生石灰,实验中观察到C溶液中先形成沉淀,而后沉淀溶解,当溶液恰好澄清时,关闭E,然后将C放入盛有沸水的烧杯中,静止片刻,观察到试管壁上出现光亮银镜。则A是,C是与葡萄糖的混合液。仪器D在此实验中的作用是。
(4)利用此套装置设计实验证明碳酸、醋酸、苯酚的酸性强弱,则A、B、C中放的试剂分别是、、,B、C的实验现象分别为B、C。若使现象明显,放入C中的溶液应是稀溶液还是浓溶液。(填浓或稀)
(18分)
氢氧化铜是一种常用试剂。例如,利用新制氢氧化铜验证醛类物质的还原性。
(1)新制氢氧化铜悬浊液的配制实验室制取新制氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2 mL,滴入2%的硫酸铜溶液4滴∽6滴,振荡即成。这样操作的目的是。
下面是三个研究性学习组分别从不同层面开展研究性学习活动:
(2)研究性学习小组甲:对教材实验结论"乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O"提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究:提出猜想:。
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应;③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
方案3:称取红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次至到固体恒重,称得质量为bg,比较a,b关系
方案4:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出。你认为合理的方案是。
(3)研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图所示。你认为要测定上述红色沉淀成分必须测定下列哪些物理量:。
①通入氢气体积;②反应前,红色沉淀+硬质玻璃管的总质量;③完全反应后红色固体+硬质玻璃管的总质量;④实验前,干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量
(4)研究性学习小组丙上网查阅新闻得知,"2005年诺贝尔化学奖授予了三位研究绿色化学的科学家"。绿色化学强调对环境友好,实现零排放。"变废为宝"符合绿色化学要求。他们收集上述红色沉淀制备化学试剂--蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案:。
某课外活动小组以胆矾为原料进行如下实验:
I、测定晶体中结晶水的含量:
测定硫酸铜晶体(CuSO4·5H2O)里结晶水的含量,实验步骤为:①研磨②称量空坩埚和装有试样的坩埚的质量③加热④冷却⑤称量⑥重复③至⑤的操作⑦根据实验数据计算硫酸铜结晶水的含量。
(1)第④步需要使用的仪器是。
(2)判断晶体是否完全失水的方法是:。
(3)根据实验数据计算得出硫酸铜结晶水的含量为5.3 ,估计造成误差的原因可能有
(提出两点可能的原因)。
II、用胆矾制得氧化铜固体来探究氧化铜的性质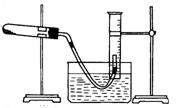
(1)取一定质量的氧化铜固体和一定质量的氯酸钾固体,混合均匀后用如图所示的装置加热制取氧气。为证明氧化铜在氯酸钾的分解反应中起催化剂的作用,在上述实验后还应该进行的实验操作是(按实验先后填写字母顺序)。然后进一步证明该固体为氧化铜。
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(2)但有同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你同意吗?若同意,要进行的另一个实验是;若不同意,说明理由。