【改编】氯化溴(BrCl)化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和非金属反应生成相应的卤化物,关于BrCl叙述错误的是
| A.固态溴化碘是由极性键构成的分子晶体 |
| B.跟水反应的化学方程式为BrCl+ H2O =" HCl+" HBrO |
| C.BrCl氧化性强于Cl2 |
| D.与水反应时BrCl既是氧化剂又是还原剂 |
下列实验现象预测正确的是()
| A.实验I:振荡后静置,上层溶液颜色保持不变 |
| B.实验II:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
| C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
D.实验IV :继续煮沸溶液至红褐色沉淀停止加热,当光束通过体系时可产生丁达尔效应 :继续煮沸溶液至红褐色沉淀停止加热,当光束通过体系时可产生丁达尔效应 |
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是()
| A.常压下,五种元素的单质中,Z单质的沸点最高 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物比X的氢化物的稳定性高 |
| D.Y元素比W元素的非金属性强 |
下列说法不正确的是()
| A.目前人们发现的元素仅一百多种,但是却有几百种不同的原子 |
| B.核外电子运动离核越近则能量越低 |
C.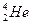 与 与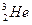 互称为同位素,其 互称为同位素,其 物理性质几乎完全相同 物理性质几乎完全相同 |
| D.一种原子的质量数近似地等于这种原子的相对原子质量 |
下列叙述正确的是()
| A.Li在氧气中燃烧主要生成Li2O2 |
| B.将CO2通入NaClO溶液中可生成HClO |
| C.将SO2通入Ba(OH)2溶液中无沉淀生成 |
| D.将NH3通入热的CuSO4溶液中,能使Cu2+还原成Cu |
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO 2体积(V)的关系如图,图中AB段表示的先后离子方程式是()
2体积(V)的关系如图,图中AB段表示的先后离子方程式是()
①CO2+OH-=HCO3-
②CO2+2OH-=CO32-+H2O
③CO32-+Ba2+=BaCO3↓
④BaCO3+CO2+H2O=Ba2++2HCO3-
⑤CO32-+CO2+H2O=2HCO3-
| A.②⑤ | B.⑤④ | C.④② | D.④① |