下列说法正确的是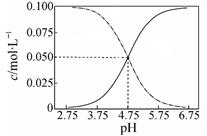
| A.常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4③ (NH4)2Fe(SO4)2三种溶液中水的电离程度:③>②>① |
| B.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如上图所示,当pH=4.5溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| C.向Ca(OH)2溶液中加入过量的NaHCO3溶液: Ca2++2HCO3-+2OH-→ CO32-+CaCO3↓+2H2O |
| D.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在如下关系:Kw ·K = Ka |
下列有关化学反应速率的说法正确的是( )
| A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 |
| B.100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
| C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢 |
| D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 |
已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则关于方程式2H2O(l)===2H2(g)+O2(g)的ΔH的说法中正确的是( )
| A.方程式中的化学计量数表示分子数 | B.该反应ΔH大于零 |
| C.该反应ΔH=-571.6 kJ/mol | D.该反应可表示36 g水分解时的热效应 |
下列是4位同学在学习“化学反应速率与化学平衡”一章后的观点,你认为不正确的是( )
| A.化学反应速率理论是研究怎样在一定时间内快出产品 |
| B.化学平衡理论是研究怎样使用有限原料多出产品 |
| C.化学反应速率理论是研究怎样提高原料转化率 |
| D.化学平衡理论是研究怎样使原料尽可能多地转化为产品 |
在化工生产中,如果再加快反应速率,应该优先考虑的科研方向是( )
| A.提高设备强度,以便加压 | B.选择适宜的催化剂 |
| C.采用高温 | D.用块状反应物代替粉末状反应物 |
下列反应中可判断为可逆反应的是( )
| A.氢气和氯气点燃生成氯化氢,氯化氢受热分解为氢气和氯气 |
| B.氮气和氢气在高温、高压、催化剂作用下可以生成氨气,同时氨气又分解为氮气和氢气 |
| C.单质溴可以置换出碘,氯气又可以置换出溴 |
| D.氯气和水反应生成盐酸和次氯酸,次氯酸光照条件下可分解为盐酸和氧气 |