某温度下,对于反应N2(g)+3H2(g) 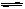 2NH3(g) ;△H=-92.4kJ/mol。
2NH3(g) ;△H=-92.4kJ/mol。
N2的平衡转化率(α)与体系总压强(P)的关系如右图所示。下列说法正确的是:
A.将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ
B.平衡状态由A变到B时,平衡常数K(A) < K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率提高
D.保持压强不变,通入惰性气体,平衡常数不变,平衡不移动
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、NO2、N2O4)的混合物共0.8mol,这些气体恰好能被500mL 2.0mol/L NaOH溶液完全吸收,溶液中生成NaNO3和NaNO2,则原混合气体中NO的物质的量为
| A.0.3mol | B.0.4mol | C.0.5mol | D.0.6mol |
金属铈(稀土元素)性质活泼。铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。下列说法正确的是
| A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI ="=" CeI4 + 2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + Fe2+ = Ce3+ + Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阳极获得铈 |
D.四种铈的核素 Ce、 Ce、 Ce、 Ce、 Ce、 Ce、 Ce,它们互称为同素异形体 Ce,它们互称为同素异形体 |
下列说法中正确的是(NA表示阿伏加德罗常数)
| A.40gSO2气体所占的体积为11.2L |
| B.7.1gC12与水反应转移电子数为0.2NA |
| C.1mol/L的CH3COONa溶液中,CH3COO-离子数小于NA |
| D.常温常压下,32gO2和O3的混合气体含氧原子数为2NA |
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。判断下列说法中,正确的是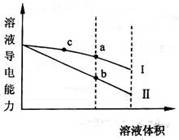
| A.两溶液稀释前的浓度相同 |
| B.a、b、c三点溶液的pH由大到小顺序为a>b>c |
| C.a点的Kw值比b点的Kw值大 |
| D.a点水电离的c(H+)大于c点水电离的c(H+) |
某溶液含有①NO3-、②HCO3-、③SO32-、④CO32-、⑤SO42—五种阴离子。现向其中加入少量的Na2O2固体后,溶液中离子浓度增大的是(设溶液体积无变化)
| A.① | B.④ | C.①④⑤ | D.④⑤ |