已知:CO2(g) + 3H2(g) 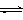 CH3OH(g) + H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
CH3OH(g) + H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
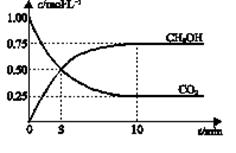
A.10min后,升高温度能使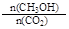 增大 增大 |
| B.反应达到平衡状态时,CO2的平衡转化率为75% |
| C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol·L-1•min-1 |
下列关于NO的说法正确的是()
| A.NO是红棕色气体 | B.常温下氮气与氧气反应可生成NO |
| C.NO溶于水可以生成硝酸 | D.NO是汽车尾气的有害成分之一 |
香烟烟雾中往往含有CO和SO2气体,下列关于这两种气体的说法正确的是()
| A.两者都易溶于水 | B.两者都污染环境,危害健康 |
| C.两者都能使品红溶液褪色 | D.两者都是形成酸雨的主要原因 |
金属铜不能够与浓盐酸反应,却能够与浓硫酸反应,是因为浓硫酸具有()
| A.脱水性 | B.吸水性 | C.强酸性 | D.强氧化性 |
教材中氨的喷泉实验体现了氨的哪一种性质()
| A.还原性 | B.比空气轻 | C.很易液化 | D.极易溶于水 |
检验氨气可选用()
| A.湿润的蓝色石蕊试纸 | B.干燥的红色石蕊试纸 |
| C.干燥的蓝色石蕊试纸 | D.湿润的红色石蕊试纸 |